ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Пищеварительные липолитические ферменты
Липолизом называется гидролиз липидов, липолитическими ферментами – ферменты, катализирующие гидролиз липидов. К пищеварительным липолитическим ферментам относятся липазы желудка, липаза, фосфолипаза и холестераза кишечника. Липаза желудка – слабоактивная гидролаза, гидролизует жиры молока. Липаза тонкого кишечника – гидролитический фермент, катализирующий гидролиз жиров. Продуктами гидролиза являются моно-и диацилглицериды, глицерин, жирные кислоты. Оптимум рН 7,8–8,2. Активатором являются желчные кислоты. Обязательным условием переваривания жиров является их эмульгирование. К природным эмульгаторам жиров относятся сывороточный альбумин и желчные кислоты. Фосфолипазы – гидролазы, катализирующие гидролиз фосфопидов в тонком кишечнике. Активатором фосфолипаз и эмульгаторов фосфолипидов являются желчные кислоты. К фосфолипазам относятся фосфолипазы А, В, С, Д, которые последовательно гидролизуют молекулу фосфолипидов. Первый фермент – фосфолипаза А – отщепляет ненасыщенную жирную кислоту от второго углеродного атома глицерина, в результате чего образуется лизофосфолипид, который обладает свойствами эмульгатора. Далее последовательно действуют фосфолипазы В, С и Д, которые расщепляют молекулы фосфолипида на глицерин, жирную и фосфорную кислоты и азотистое основание.
Пищеварительные гликозидазы Гликозидазы (амилолитические ферменты, глюкозидазы, карбогидразы) –гидролитические ферменты, катализирующие гидролиз поли- и олигосахаридов в желудочно-кишечном тракте. К ним относятся α-амилаза, α-декстриназа и мальтаза слюны, α-амилаза, мальтаза, сахараза и лактаза кишечника. α-Амилаза (птиалин) и β-амилаза (α-декстриназа} – гидролазы, которые вырабатываются слюнными железами. Оптимум рН 6,8–7,2. Активатором амилаз являются ионы С1-; субстратом для α-амилазы – растительный и животный крахмал, продуктом гидролиза – декстрины. Для β-амилазы основным субстратом являются декстрины, продуктом гидролиза – мальтоза. Декстрины – это полисахариды с более низкой степенью полимеризации, чем крахмал. Для определения активности амилазы слюны используется "пороговый" метод определения амилазной активности по Вольгемуту. Он основан на определении минимального "порогового" количества фермента, способного расщеплять 1 см3 0,1 %-го раствора крахмала за 30 мин при температуре 38 °С. Данное минимальное количество фермента принимают за единицу амилазной активности. Амилазная активность слюны, или амилокластическая сила слюны (А), выражается количеством 0,1 %-го раствора крахмала (в см3), которое расщепляется 1 см3 неразведенной слюны при температуре 38 °С в течение 30 мин. В норме амилазная активность слюны ( Мальтаза – гидролаза, которая вырабатывается слюнными железами. Активатором являются ионы С1-, субстратом – мальтоза, продуктом гидролиза – глюкоза. Оптимум рН 6,8–7,2. α-амилаза β-амилаза мальтаза
Кишечный сок – пищеварительный сок, выделяемый либеркюновыми железами слизистой оболочки кишечника. В состав сока входят следующие гликозидазы: слабоактивная амилаза, мальтаза, сахараза (инвертаза), лактаза. Поджелудочной железой вырабатывается панкреатический сок, который содержит такие ферменты, как амилаза, мальтаза и сахароза. Панкреатический сок поступает в двенадцатиперстную кишку. Для гликозидаз тонкого кишечника физиологический диапазон рН 7,8—8,2. В кишечнике происходят следующие процессы: α-амилаза
крахмал декстрины
β-амилаза
декстрины мальтоза
мальтаза
мальтоза глюкоза
сахараза
сахароза глюкоза фруктоза лактаза
лактоза глюкоза фруктоза
Образующиеся моносахариды по воротной вене всасываются в печень. 6.2. Ферменты цикла Кребса
Цикл Кребса (цикл лимонной кислоты, цикл трикарбоновых кислот) является метаболическим энергетическим "котлом" для животного организма и включает 10 ферментативных реакций, четыре из которых являются окислительно-восстановительными. В ходе реакций освобождается 70 % энергии. Чрезвычайно велика биологическая роль этого цикла, поскольку это общий конечный путь окислительного распада всех основных пищевых продуктов. В процессе окисления топливных молекул (углеводов, аминокислот, жирных кислот) происходит обеспечение организма энергией в виде АТФ. Топливные молекулы вступают в цикл Кребса после превращения в ацетил-КоА. Кроме того, цикл трикарбоновых кислот поставляет промежуточные продукты для процессов биосинтеза и происходит в матриксе митохондрий. Рассмотрим реакции цикла Кребса. Реакция 1. Цикл начинается с конденсации четырехуглеродного компонента оксалоацетата и двухуглеродного компонента ацетил-КоА. Реакция катализируется цитратсинтазой и представляет собой альдольную конденсацию с последующим гидролизом.
Промежуточным продуктом является цитрил-КоА, который гидролизуется на цитрат и КоА:
Реакция 2. Реакция дегидратации, которая катализируется ферментов аконитазой. Реакция 3. Реакция гидратации, которая также катализируется ферментом аконитазой.
Реакция 4. Это первая окислительно-восстановительная реакция:
Эта реакция катализируется анаэробной дегидрогеназой, содержащей кофермент НАД. Реакция 5.
Реакции 4 и 5 представляют собой окислительное декарбоксилирование, катализируются изоцитратдегидрогеназой, промежуточным продуктом реакций является оксалосукцинат. Реакция 6. Также является реакцией окислительного декарбоксилирования, т.е. это вторая окислительно-восстановительная реакция:
Реакция катализируется α-оксоглутаратдегидрогеназным комплексом, состоящим из трех ферментов:
Реакция 7. В сукциниле имеется связь, богатая энергией. Расщепление тиоэфирной связи сукцинил-КоА сопряжено с фосфорилированием гуанозиндифосфата (ГДФ):
Фосфорильная группа ГТФ легко переносится на АДФ с образованием АТФ:
Это единственная реакция цикла, являющаяся реакцией субстратного фосфорилирования.
Реакция 8. Это третья окислительно-восстановительная реакция:
Реакция 9.
Реакция 10. Четвертая окислительно-восстановительная реакция:
Эта реакция катализируется анаэробной дегидрогеназой, содержащей кофермент НАД. В цикле Кребса образуются углекислый газ, протоны и электроны. Четыре реакции цикла являются окислительно-восстановительными. Катализируются ферментами-дегидрогеназами, содержащими коферменты НАД, ФАД. Коферменты захватывают образующиеся Н+ и ē и передают их в дыхательную цепь (цепь биологического окисления). Элементы дыхательной цепи находятся на внутренней мембране митохондрий. Дыхательная цепь – это система окислительно-восстановительных реакций, в ходе которых происходит постепенный перенос Н+ и ē к О2, который поступает в организм в результате дыхания. В дыхательной цепи происходит образование АТФ. Основными переносчиками ē в цепи являются железо- и медьсодержащие белки (цитохромы), кофермент Q (убихинон). В цепи находятся пять цитохромов (b1, c1, c, a, a1):
Схема цикла Кребса
Простетической группой цитохромов в, с1, с является железосодержащий гем. Механизм действия данных цитохромов основан на том, что в их составе имеется атом железа с переменной валентностью, который может находиться как в окисленном, так и в восстановленном состоянии в результате переноса ē и Н+
Fe3+ + ē ↔ Fe2+; Fe2+ – ē ↔ Fe3+
Цитохромы а и а3 образуют комплекс цитохромоксидазу, которая является последним звеном дыхательной цепи. Помимо железа цитохромоксидаза содержит медь с переменной валентностью. При транспортировке ē от цитохрома а3 к молекулярному О2 происходит процесс: Cu1+ – ē ↔ Cu2+
Итоговая реакция, которая происходит на цитохромоксидазе, имеет вид:
О2 + 4Н+ + 4 ē → 4Н2О
Энергетический баланс цикла Кребса и дыхательной цепи – 24 молекулы АТФ.
6.3. Ферменты тканевого метаболизма глюкозы
В животных клетках глюкоза и гликоген распадаются анаэробным и аэробным путями. Распад глюкозы происходит в цитоплазме (цитозоле). Аэробный распад характерен для тканей, обогащенных кислородом, анаэробный – для тканей с недостатком кислорода. Анаэробный распад Анаэробный распад глюкозы и гликогена происходит в клетках мышечной ткани животного организма.
Кроме того, анаэробное превращение глюкозы характерно для многих микроорганизмов. Такой путь распада называется дихотомическим (от греч. dicha – на две части + toma – сечение), так как в процессе наблюдается образование из одной молекулы гексозы (шесть С-атомов) двух молекул триоз, содержащих по три С-атома. Конечный продукт анаэробного превращения – молочная кислота (СН3–СН(ОН)–СООН). Рассмотрим уравнения реакции анаэробного распада. Следует отметить, что в организме любой метаболический путь начинается с активации исходного соединения. Активация осуществляется основной биохимической реакцией – переносом фосфорильной группы от АТФ в результате фосфорилирования.
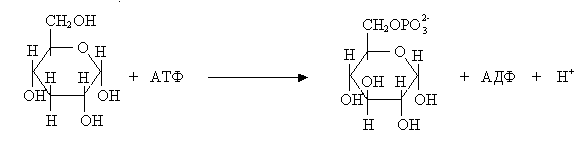
Реакция 1. Начальная реакция – фосфолирование глюкозы при участии АТФ с образованием глюкозо-6-фосфата (активной формы). Фермент, катализирующий перенос фосфорильной группы от АТФ к акцептору называется и киназой. Реакция 2. Это реакция изомеризации глюкозо-6-фосфата во фруктозо-6-фосфат (альдозы в кетозу). Реакция идет с участием фермента глюкозофосфатизомеразы.
Реакция 3. Данная реакция является реакцией фосфорилирования, катализируется ферментом фосфофруктокиназой.
Реакция 4. Настоящая реакция является реакцией дихотомического распада гексозы на две триозы; катализируется ферментом альдолазой.
Реакция 5. Данная реакция является реакцией изомеризации; катализируется ферментом изомеразой. Реакция 6. Реакция катализируется ферментом глицеральдегид-3-фосфатдегидрогеназой.
Реакция 7. Это реакция гликолиза, в которой происходит образование АТФ; катализируется фосфоглицерокиназой.
Реакция 8. Данная реакция является реакцией внутримолекулярного перемещения фосфатной группы, катализируется ферментом мутазой.
Реакция 9. Это реакция дегидратации, которая катализируется ферментом енолазой.
Реакция 10. Реакция является реакцией субстратного фосфорилирования, приводит к образованию пирувата и АТФ; катализируется ферментом пируваткиназой.
Реакция 11. Данная реакция катализируется ферментом лактатдегидрогеназой, конечный продукт – молочная кислота. Образование лактата является завершающей реакцией анаэробного гликолиза. Энергетический баланс – две молекулы АТФ.
При интенсивной мышечной деятельности молочная кислота накапливается в мышцах и воздействует на нервные окончания, вызывая боль в мышцах. Возвращаясь в печень, молочная кислота участвует в глюконеогенезе. Анаэробный гликолиз характерен также для посмертных изменений мышечной ткани и характеризует первые три стадии посмертного распада: предсмертный период, первоначальный период посмертных изменений, окоченение.
Аэробный распад глюкозы
Аэробный распад глюкозы – это основной путь превращения углеводов в тканях, необходимый для обеспечения организма энергией. Он происходит непрямым (дихотомическим) или прямым (апотомическим) путями. Аэробный непрямой распад глюкозы протекает в тканях, богатых кислородом (мозг, легкие). В результате такого распада глюкоза полностью распадается до СО2 и Н2О (с выделением большого количества энергии):
Процесс окисления глюкозы происходит в три этапа: 1. Распад глюкозы до пировиноградной кислоты (ПВК). 2. Превращение ПВК в ацетил-КоА (СН3СО – SКоА) в цикле Кребса. 3. Дыхательная цепь. Промежуточные продукты анаэробного и аэробного непрямого распада до стадии образования ПВК идентичны. Для аэробного непрямого распада характерно образование ацетил-КоА из пирувата по схеме
Реакция катализируется пируватдегидрогеназным комплексом. Далее ацетил-КоА включается в цикл Кребса. Энергетический баланс – 38 молекул АТФ. Аэробный прямой распад глюкозы является апотомическим. В нем имеет место прямое окисление молекулы глюкозы без предварительного ее расщепления на две триозы. Этот распад называется пентозным циклом, так как при прямом окислении глюкозы образуется пентоза и выделяется СО2. Такое окисление углеводов называется гексозомонофосфатным. Прямой распад характерен для тканей, в которых происходит интенсивный синтез жирных кислот и ароматических липидов (молочная железа, надпочечники, жировая ткань и печень). Гексозомонофосфатный распад "поставляет" пентозы для биосинтеза нуклеиновых кислот.
6.4. Тканевые протеолитические ферменты
Тканевой протеолиз, т. е. гидролиз тканевых белков с участием тканевых протеолитических ферментов, называется автолизом, а ферменты – катепсинами. Катепсины подразделяются А, В, С, D, Е, Н, N, L, S. По локализации выделяют две группы катепсинов. К первой группе относятся кислые катепсины. Они локализованы в лизосомах клеток, где происходит основной процесс гидролиза белков, и составляют 85–90 % от общего содержания катепсинов в клетках. Ко второй группе относятся основные и нейтральные катепсины. Они локализованы в цитозоле и эндоплазматическом ретикулуме и составляют 10–15 % от общего содержания катепсинов. В основном катепсины являются кислыми протеиназами. Катеп-син В относится к тиоловым протеиназам. По специфичности действия катепсины подразделяются на экзопептидазы (С, А, Н) и эндопептидазы (В, N, L, S, D). Катепсин С отщепляет дипептид с N-конца полипептидной цепи, имеет оптимум рН 5,0–6,0. Катепсин А аналогичен карбоксипептидазе, оптимум рН 5,0–5,5. Катепсин В является аналогом трипсина, оптимум рН 5,5—6,0. Катепсин Н подобен аминопептидазе, наиболее активен в клетках печени, оптимум рН 6,0–7,0. Катепсин N при рН 3,6–6,0 гидролизует нативный коллаген, при рН 6 — растворимый коллаген. Катепсин L аналогичен химотрипсину, оптимум рН 5,0. Катепсин D имеет оптимум рН 4,0. Тканевые протеиназы активны в период посмертных изменений тканей.
6.5. Бактериальные ферменты. Роль бактериальных ферментов в образовании продуктов гниения
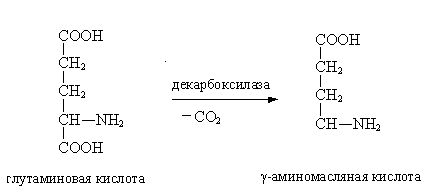
Бактериальные ферменты катализируют процессы гниения в кишечнике и тканях. Продукты гниения образуются в основном в результате дезаминирования и декарбоксилирования аминокислот. Дезамияированием называется процесс отщепления от аминокислоты группы –NН2, который контролируется ферментами дезаминазами. Для человеческого организма характерно внутримолекулярное и окислительное дезаминирование. Декарбоксилирование аминокислот –отщепление от аминокислоты СO2 – контролируют бактериальные ферменты декарбоксилазы. Декарбоксилазы и дезаминазы содержат витамин В6. Основными продуктами гниения являются путресцин, кадаверин, фенол, скатол, индол, крезол, гистамин, тирамин, триптамин.
Одним из наиболее важных аминов гниения является путресцин (от англ. putrescence – гниение). Кадаверин (от лат. cadaver – труп) также является характерным амином гниющих продуктов. Кроме того, данные соединения участвуют в формировании запаха животных, мочи и фекалий, неприятного запаха изо рта, являются предшественниками трупных ядов. Из триптофана после разрушения бактериями боковой цепи образуется скатол и индол.
В результате декарбоксилирования микроорганизмов ферментами из орнитина образуется путрисцин, из лизина – кадаверин:
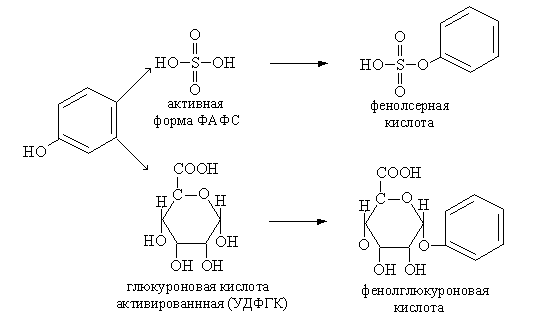
В печени и кишечной стенке продукты гниения обезвреживаются в реакциях "защитного синтеза". Скатол и индол предварительно окисляются в скатоксил и индоксил.
Фенол, крезол, индоксил, скатоксил обезвреживаются в печени путем синтеза парных соединений с серной и глюкуроновой кислотами. Данные соединения не ядовиты, выделяются с мочой наружу. Фенол, крезол, индоксил, скатоксил реагируют не со свободным сульфатом, а с его активной формой – фосфоаденозинфосфосульфатом (ФАФС) или глюкуроновой кислотой (УДФГК – уридиндифосфоглюкуроновая кислота).
В почках индоксилсерная кислота реагирует с КНСО3, в результате чего образуется "животный" индикан (калиевая соль).
При сбалансированном аминокислотном питании в моче здоровых животных содержится 10% индикана, индикан выделяется с мочой при длительной задержке продуктов переваривания белков в кишечнике.
При избытке в рационе животных фенилаланина, или в результате его недоступности для протеиназ, фенилаланин превращается в бензойную кислоту:
В печени и почках бензойная кислота обезвреживается взаимодействием с глицином:
Серосодержащие аминокислота также образуют характерные продукты гниения – меркаптаны (RSH), метан (СН4), сероводород (SH2), метиламин (CH3NH2). РАЗДЕЛ 7. НЕКОТОРЫЕ ФЕРМЕНТЫ РАСТИТЕЛЬНЫХ ОБЪЕКТОВ
7.1. Оксидоредуктазы растений Полифенолоксидаза растительных объектов
Полифенолоксидаза (ПФО), или катехолоксидаза, или фенолоксидаза, является важным ферментом растительных тканей, катализирует окисление о-дифенолов до о-дихинонов (дифенолоксидазная активность) или о-гидроксилирование монофенолов (монофенолгидрооксилазная, или крезолазная, активность). Полифенолоксидаза – это медьсодержащий фермент. Субстратами для него являются пирокатехин, катехол, галловая кислота, хлорогеновая кислота и др. Оптимальный диапазон рН 5,0–7,0. Полифенолоксидаза находится в пластидах всех типов клеток высших растений (в хлороплас-тах, лейкопластах) в виде профермента прополифенолоксидазы. Активаторами латентной формы являются протеазы и жирные кислоты.
Полифенолоксидаза проявляет активность в онтогенезе растений, например при старении, повреждениях, патогенезе. Определение активности полифенолоксидазы в растительных тканях проводится фотоколориметрическим методом Бояркина (по развитию окраски в окислительно-восстановительных реакциях, сопряженных с окислением фенолов). В данном случае используется система пирокахетин-фенилен-диамин или пирокахетиндиэтил-р-фенилендиамин:
|









 Холестераза относится к гидролазам. Субстратом для нее являются эфиры холестерина (сложносвязанная форма холестерина). Оптимум рН 7,8–8,2. Активатор – желчные кислоты. Продукты гидролиза – свободный холестерин и кислоты.
Холестераза относится к гидролазам. Субстратом для нее являются эфиры холестерина (сложносвязанная форма холестерина). Оптимум рН 7,8–8,2. Активатор – желчные кислоты. Продукты гидролиза – свободный холестерин и кислоты.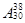 ) равна 160–320.
) равна 160–320.
 (С6Н10О5)n
(С6Н10О5)n  (С6Н10О5)m + m Н2О 2m C12H22O11;
(С6Н10О5)m + m Н2О 2m C12H22O11; C12H22O11 + Н2О 2С6Н12О6;
C12H22O11 + Н2О 2С6Н12О6; C12H22O11 + Н2О С6Н12О6 + С6Н12О6
C12H22O11 + Н2О С6Н12О6 + С6Н12О6





 α-Оксоглутарат + НАД + КоА Сукцинил-КоА + СО2 + НАДН
α-Оксоглутарат + НАД + КоА Сукцинил-КоА + СО2 + НАДН

 Сукцинил-КоА + ~ Ф +ГДФ Сукцинат + ГТФ +КоА
Сукцинил-КоА + ~ Ф +ГДФ Сукцинат + ГТФ +КоА ГТФ + АДФ АТФ + ГДФ
ГТФ + АДФ АТФ + ГДФ















 С6Н2О6 + 6О2 6СО2 + 6Н2О + энергия.
С6Н2О6 + 6О2 6СО2 + 6Н2О + энергия. Пируват + НАД + КоА Ацетил-КоА + СО2 + НАДН.
Пируват + НАД + КоА Ацетил-КоА + СО2 + НАДН.