ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Коррозия металлов и сплавов
Методические указания
Коррозия металлов и сплавов определяется как процесс самопроизвольного разрушения металлов и сплавов при их химическом, электрохимическом или биохимическом взаимодействии с агрессивной окружающей средой. По механизму коррозионного процесса различают два основных типа коррозии металлов: химическую и электрохимическую. Химическая коррозия протекает при повышенных температурах в агрессивной газовой среде или в среде неэлектролитов.
2Sn + O2 = 2SnO 2Fe + 3Cl2 =2 FeCl3 При газовой коррозии в одних случаях реакция протекает до полного разрушения металла, в других _ на поверхности металла образуется защитная пленка из продуктов коррозии, тормозящая процесс дальнейшего окисления металла.
Электрохимическая коррозия протекает в средах с ионной проводимостью (в растворах электролитов, во влажном воздухе, в почве). Металлы, применяемые в технике, практически всегда содержат различные примеси. При соприкосновении с раствором электролита система из основного металла и частиц примеси образует микрогальванопару. При этом анодом является более активный металл, а катодом – менее активный металл, загрязненный или замасленный участок, или участок, к которому кислород воздуха поступает с большей скоростью. В качестве электролита служит вода или другой полярный растворитель с растворенными в нем оксидами, щелочами солями, кислородом. Электрохимическая схема гальванопары имеет вид;
(-)Анод; активный участок/раствор электролита/менее активный; Катод(+)
Процессы, протекающие при электрохимической коррозии, зависят от природы металлов, природы электролита, его состава, кислотности среды, температуры и многих других факторов. Анодный процесс всегда один и тот же – окисление более активного металла: Мео - ne = Men+. Катодный процесс зависит от состава электролита и его рН. Обычно, катодным процессом является восстановление водорода или растворенного кислорода. Восстановление водорода протекает по схемам: - в кислой среде 2Н+ + 2е = Н2 - в щелочной среде 2Н2О + 2е = Н2 + 2ОН-. Потенциал этого процесса, согласно уравнению Нернста зависит от рН
Е = Ео2Н+/Н2 + 0,059/2 lgC2H+ = - 0,059pH.
Восстановление кислорода протекает по схемам: - в кислой среде О2 + 4Н+ + 4е = 2Н2О - в щелочной среде О2 + 2Н2О + 4е = 4ОН-. Потенциал этого процесса определяется по формуле:
E = EoO2|2H2O + 0,059/2 lgC2H+ = 1,23 + 0,059pH.
Процесс отвода электронов с катодного участка при электрохимической коррозии называется деполяризацией, а вещества, применяемые для этого – деполяризаторами. Поэтому, при восстановлении водорода процесс коррозии называется процессом с водородной деполяризацией, а при восстановлении кислорода – процессом с кислородной деполяризацией. Скорость коррозии возрастает с увеличением температуры, концентрации окислителей и веществ, препятствующих образованию пассивирующей пленки (СГ, CN-, NH3), разности потенциалов катодных и анодных участков. Обычно скорость коррозии выражается объёмным или массовым показателями: 1) объемный показатель коррозии ( л/см2ч)
Kv = V /( S Dt) где V – объем водорода ( л ), выделяющегося за время Dt ( ч ) с образца площадью S (см2 ) 2) массовый показатель коррозии ( г/см2ч )
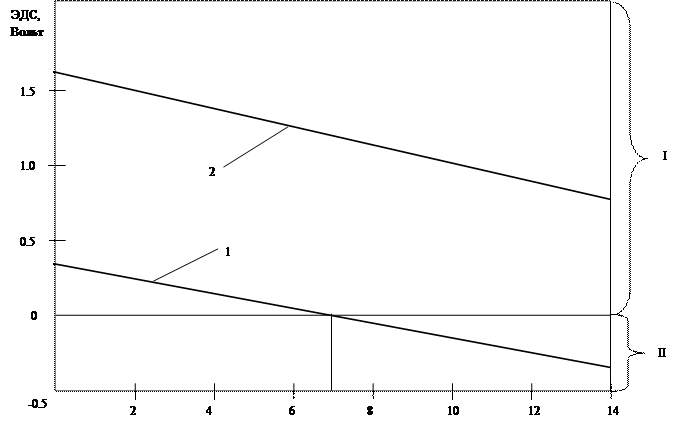
Km = Dm/ (S Dt); Где Dm – уменьшение массы образца ( г ) площадью S ( см2 ) за время Dt ( ч ). Пример 1. С каким видом деполяризации подвергается коррозии свинец в растворе с рН = 4,0, если Е0Pb =-0,126V. Решение. Условием протекания коррозии является соотношение Ек > Еа, вытекающее из условия положительного значения ЭДС коррозионного процесса т.е. Ек - Еа> 0. Вычислим потенциал катодной реакции: при водородной деполяризации Ек1 = - 0,059.4 = - 0,236 В, при кислородной деполяризации Ек2 = 1,23 – 0,059рН = 1,23 – 0,059.4 = 0,944 В. Отсюда видно, что условию протекания коррозии удовлетворяет соотношение электродных потенциалов для кислородной деполяризации, т. е. 0,944>-0,126. Поэтому в растворе с рН = 4,0 свинец подвергается коррозии только с кислородной деполяризацией. Пример 2. В результате коррозии свинцовой проволоки диаметром 5мм и длиной 10 см её масса уменьшилась на 0,04 г за 11 часов. Рассчитать массовый и объёмный показатели коррозии, считая, что процесс протекает только с водородной деполяризацией. Написать уравнения анодного и катодного процессов коррозии Решение. Массовый показатель коррозии вычисляем по формуле Km = Dm/(SDt) = Dm/pdlDt) = 0,04/(3,14.0,5.10.11) = 0,0023 г/(см2 ч) Объёмный показатель коррозии определим по формуле Kv=V/(SDt) Объём водорода вычислим по закону эквивалентов: nэPb = nэН отсюда mPb/mэPb = VH2/VэН2; VH2 = (mPb VЭН2)/ mЭPb, где mЭPb – эквивалентная масса свинца, г/моль; VЭН2 – эквивалентный объём водорода при н.у., л/моль. Учитывая, что фактор эквивалентности свинца равен ½, т.к. свинец окисляется до состояния Pb2+, получаем: KV = (mPb.VЭН2)/(mЭPbpdlDt) = 0,04.11,2/(103,5.3,14.0,5.10.11) = 2,5.10-5 (л/см2.ч) Уравнения процессов коррозии: анодный : Pb - 2e = Pb2+ катодный : 2H+ + 2e = H2. Пример 3. Определите области рН, в которых Cd подвергается коррозии: а) со смешанной деполяризацией; б) только с кислородной деполяризацией, учитывая, что стандартный потенциал кадмия Eo = - 0,40 V. Решение. Термодинамическая возможность коррозии определяется условием ЕК > ЕА , где ЕК – потенциал восстановления окислителя, ЕА – потенциал окисления металла. Исходя из уравнения Нернста, выражения для потенциалов восстановления ионов водорода и кислорода имеют вид ЕН = - 0,059рН ЕО = 1,23 – 0,059рН. Определение областей рН сводится к графическому или аналитическому определению интервалов рН, в которых: а ) ЕН > ЕCd, б ) ЕО > ЕCd > EH. Определим равновесные равновесные потенциалы реакций деполяризации для граничных значений рН, обозначив Е1 – потенциал реакции водородной деполяризации и Е2 – потенциал реакции кислородной деполяризации. Для водороной деполяризации: Е1,рН=0 = - 0,059рН = -0,059 .0 = 0,0 В Е1,рН=14 = -0,059рН = - 0,059 .14 = - 0,826 В Для кислородной деполяризации: Е2,рН=0 = 1,23 – 0,059.рН = 1,23 – 0,059 .0 = 1,23 В; Е2,рН=14 = 1,23 – 0,059.рН = 1,23 – 0,059.14 = 0,403 В Возможность коррозии с той или иной деполяризацией при данном значении рН оценивается по знаку ЭДС. Если ЭДС положительна, то металл при данном рН подвергается коррозии, если ЭДС отрицательная или равна 0, то коррозии не будет. Рассчитаем значения ЭДС для граничных значений рН: - с водородной деполяризацией ЭДС1рН=0 = Е1,рН=0 – ЕCd = 0 – (-0,403) = 0,403 V ЭДС1рН=14 = Е1рН=14 – ЕCd = - 0,826 – (-0,403) = -0,423 V - с кислородной деполяризацией ЭДС2рН=0 = Е2рН=0 – ЕCd = 1,23 – (-0,403) = 1,632 V ЭДС2рН=14 = Е2рН=14 – ЕCd = 0,403 – (-0,403) = 0,806 V.
Графическое решение изображено на рисунке в координатах ЭДС – рН. Прямая 1 соответствует коррозии с водородной деполяризацией. Она располагается в двух областях: в 1 области, где коррозия имеет место,в интервале рН 0 – 6,8, во 11 области, где коррозия отсутствует, в интервале рН 6,8 – 14. Прямая 2, соответствующая коррозии с кислородной деполяризацией, располагается только в 1 области, где имеет место коррозия. Следовательно, кадмий подвергается коррозии с кислородной деполяризацией в интервале рН от 0 до 14, и с водородной деполяризацией в интервале рН от 0 до 6,8. В интервале рН от 6,8 до 14 кадмий не будет подвергаться коррозии с водородной деполяризацией. Уравнения процесса коррозии имеют вид: Анод Cd - 2e = Cd2+ Катод 2Н+ + 2е = Н2 О2 + 4Н+ + 4е = 2Н2О. 3.10.2 Контрольные задания: 91.Будет ли медь подвергаться коррозии с водородной деполяризацией в среде с рН = 8? Ответ мотивируйте значениями потенциалов соответствующих полуреакций. Напишите электронные уравнения анодного и катодного процессов, протекающих при коррозии. 92.Будет ли висмут подвергаться коррозии с водородной деполяризацией в среде с рН = 2? Ответ мотивируйте значениями потенциалов соответствующих полуреакций. Напишите электронные уравнения анодного и катодного процессов, протекающих при коррозии. 93.В результате коррозии масса магниевой пластинки площадью 8 см2 уменьшилась на 0.18 г за 5часов. Рассчитайте массовый и объемный показатели коррозии, а также объём выделившегося водорода, считая, что коррозия протекает только с водородной деполяризацией. 94.В результате коррозии масса цинковой пластинки площадью 5 см2 уменьшилась на 0.12 г за 2часа. Рассчитайте массовый и объемный показатели коррозии, а также объём выделившегося водорода, считая, что коррозия протекает только с водородной деполяризацией. 95.При каком значении рН олово будет подвергаться коррозии с водородной деполяризацией? 96.При каком значении рН цинк будет подвергаться коррозии с водородной деполяризацией? 97.Определите, будет ли железо подвергаться коррозии с водородной деполяризацией в интервале рН от 4 до 8? Напишите анодные и катодные уравнения реакций коррозии железа. 98.При каком значении рН серебро не будет подвергаться коррозии с кислородной деполяризацией? 99.Составьте уравнения процессов, протекающих при атмосферной коррозии луженого железа при нарушении покрытия. 100.Железное изделие частично покрыто никелем. Какое это покрытие -анодное или катодное? Составьте уравнения процессов, протекающих при коррозии этого изделия во влажной атмосфере и в соляной кислоте. 3.11. Комплексные соединения 3.11.1. Методические указания
Комплексными называются соединения, содержащие комплексные ионы, способные самостоятельно существовать в растворах. В структуре комплексных соединений различают координационную (внутреннюю) сферу - группировку, состоящую из центральной частицы - комплексообразователя и окружающих его лигандов. В формулах комплексных соединений координационная сфера обозначается квадратными скобками. Число лигандов, располагающихся вокруг комплексообразователя, называется координационным числом. Ионы, находящиеся за пределом внутренней сферы, образуют внешнюю сферу комплекса. Комплексообразование особенно характерно для ионов переходных металлов, в частности для ионов Cu2+, Ag+, Au3+, Cr"+, Zn2+, Fe2+, Fe3+ и других.
Лигандами в комплексных соединениях часто бывают ионы галогенов, CN-, SCN-, NO2-, OH-,Cr2О72-, SO2-4, а также нейтральные - молекулы, например Н2О, NH3. Координационное число (К.Ч.) определяется зарядом и размерами комплексообразователя и лигандов. Строение комплексных соединений рассмотрим на примере Na[Cr(NH3)2Cl4]. Комплексообразователь лиганды ¯ ¯ ¯ Na[Cr(NH3)2Cl4]
внешняя сфера комплексный ион Заряд комплексного иона равен сумме зарядов комплексообразователя и лигандов. В зависимости от знака заряда комплексного иона различают комплексы: а) катионные - [Cu(NH3)4]Cl2, [Cr(H2О)6](NО3)3 и т.п. б) анионные - Na[Cu(NH3)Cl3], K4[Fe(CN)6] и т.п. в) нейтральные - [Zn(NH3)2Cl2], [Pt(NH3)2Cl2]. Связь между комплексообразователем и лигандами - донорно-акцепторная, а между внутренней и внешней сферами - ионная, поэтому комплексные соединения в растворах диссоциируют на комплексные ионы и ионы внешней сферы. Нейтральные комплексы являются неэлектролитами. Например: [ Cr(NH3)4Cl2]Cl = [Cr(NH3)4Cl2]+ +Cl-. Устойчивость комплексных ионов неодинакова и определяется величиной константы нестойкости (Кн). [Сr(NНз)4С12]+ = Сг3+ + 4 NH3°+ 2Сl- Кн Чем меньше значение Кнест., тем более устойчив комплексный ион. От комплексных солей следует отличать двойные соли, которые в водном растворе диссоциируют на все виды ионов, входящих в их состав: KA1(SО4)2= К+ + А13+ + 2SО42-.
3.11.2.Контрольные задания:
101.Определите степень окисления комплексообразователя в следующих соединениях [Co(NH3)2(NО2)2]Cl, К[Сr(Н2 О)2 Вг4], K2[Co(NH3)2(NО2)4]. 102.Чему равна степень окисления и координационное число комплексообразователя в соединении [Co(H2О)2(NH3)4]CI3 ? Напишите выражение для константы нестойкости комплексного иона. 103.Для соединения [Pt(NH3)4Cl2]Cl2 приведите уравнения первичной диссоциации, диссоциации комплексного иона, выражение для константы нестойкости. 104Чему равна степень окисления и координационное число комплексообразователя в соединении Na3[AlF6]? Напишите выражение для константы нестойкости комплексного иона. 105.Напишите координационную формулу соединения KCl.PtCl4.NH3. Как это вещество диссоциирует в растворах? Приведите выражение для константы нестойкости комплексного иона. 106.Назовите следующие комплексные соединения: K4[Fe(CN)6], K2[Co(NH3)2(NО2)4], [Pb(NH3)3Cl]CI. Приведите уравнения их первичной диссоциации в растворе. 107.Приведите уравнения первичной диссоциации комплексных ионов следующих соединений: хлорид гексааминокобальта (111); трифторгидроксобериллат магния. 108.Приведите уравнения первичной диссоциации комплексных ионов следующих соединений: нитрат диакватетраамин никеля (II), тетрагидроксоцинкат натрия. 109.Составьте координационные формулы солей, отвечающих составу CoBrSО4 .5NH3. Как диссоциируют эти соли в растворе? Координационное число равно шести. 110.Составьте координационные формулы солей, отвечающих составу CoClSО4 3NH3 2Н2О. Как диссоциируют эти соли в растворе? Координационное число равно шести.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК 1. Глинка, Н. Л. Общая химия [Текст] : учебник для бакалавров / Николай Леонидович Глинка ; под ред. В. А. Попкова, А. В. Бабкова. - 18-е изд., перераб. и доп. - М. : Юрайт, 2012. - 898 с. : ил. - (Бакалавр). - Библиогр.: с. 886. - Имен. указ. с. 887 - 888. - Предм. указ.: с. 889 - 898. - Доп. М-вом высш. и сред. спец. образования СССР . - ISBN 978-5-9916-1148-0 (Изд-во Юрайт). 2. Байрамов, В. М. Основы электрохимии: доп. Советом по химии УМО по классич. университетск. образованию в кач-ве учеб. пособ. для студентов вузов, обуч. по спец. 011000 "Химия" и напр. 510500 "Химия" / В. М. Байрамов; под ред. В. В. Лунина. - М.: Академия, 2005. - 240 с.: ил. - (Высшее профессиональное образование). - Библиогр.: с. 234 - 235. 3. Глинка, Н. Л. Задачи и упражнения по общей химии: доп. М-вом высш. и средн. спец. образования СССР в кач-ве учеб. пособ. для студентов нехимическ. спец. вузов / Н. Л. Глинка; под ред. В. А. Рабиновича, Х. М. Рубиной. - изд. испр. - М.: Интеграл-Пресс, 2005. - 240 с. Глинка, Н.Л.. 4. Хомченко, И. Г. Общая химия: доп. М-вом образования РФ в кач-ве учеб. пособ. для студентов учреждений сред. проф. образования / И. Г. Хомченко. - 2-е изд., испр. и доп. - М.: Новая Волна, 2005. - 464 с.: ил. - Предм. указ.: с. 444 - 455.
5. Пресс, И. А. Основы общей химии [Электронный ресурс] : учеб. пособие / И. А. Пресс. - СПб.: ХИМИЗДАТ, 2006. - 352 с. - Доп. НМС по химии М-ва образования и науки РФ. - Режим доступа: http://ibooks.ru/reading.php?productid=25194. 6. Пучкин П.А., Шалимов В.Н.. Методические указания к решению задач в курсе общей химии.- Новочерк. полит. ин-т. Новочеркасск: НПИ, 1986.-16с.
Приложение Таблица 1 Названия некоторых кислот и их кислотных остатков
Таблица 2 Термодинамические свойства простых веществ и соединений. В таблице указаны жидкое (ж) , газообразное (г) и твердое (т) состояние веществ.
Таблица 3 Термодинамические свойства ионов в водных растворах
Таблица 4
Стандартные электродные потенциалы (E°) в водных растворах
Таблица 5 Растворимость неорганических веществ в воде при комнатной температуре
Примечание: р-хорошо растворимый; +-полностью реагирует с водой; м -мало растворимый; —не уществует; н-практически нерастворимый; ?-отсутствуют данные; е-неограниченно растворимый. Учебно-методическое пособие обсуждено и одобрено на заседании кафедры «ЕНиГД» и рекомендовано к использованию в учебном процессе, протокол №0 от 20.00.2013г.
Учебно-методическое пособие рекомендовано к внутривузовскому изданию решением НМСС 100100 и 230400, протокол № 0 от 28.05.2012г.
П.А. Пучкин
Химия Учебно-методическое пособие
Редактирование и корректура авторов
Подписано к печати 07.06.12 Формат бумаги 60х 90 / 16. Объём 2,68 усл. п.л. Тираж 100 экз. Заказ № 146/12.
347383, г. Волгодонск, Ростовской обл., пр. Мира, 16,
|