 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Химическая кинетика и равновесие
Методические указания Скорость химической реакции определяется многими факторами. В первую очередь, необходимо учитывать, в какой системе (гомогенной или гетерогенной) протекает процесс. В первом случае под скоростью подразумевается изменение количества вещества в единице объема (т.е. изменение молярной концентрации) за единицу времени, во втором - изменение количества вещества, отнесенное к единице поверхности раздела фаз в единицу времени. Зависимость скорости химической реакции от природы реагирующих веществ и их концентрацией определяется законом действующих масс. Для системы аА + вВ → сС + dD он имеет вид: V=k[A]a[B]b, где к - константа скорости, определяемая природой реагирующих веществ, [А] и [В] -концентрации реагирующих веществ. Зависимость скорости от температуры определяется законом Вант-Гоффа:
Температурный коэффициент gизменяется в пределах от 2 до 4. Регулировать скорость можно и введением в систему катализаторов или ингибиторов. Для обратимой реакции при равенстве скоростей прямой и обратимой реакции наступает химическое равновесие, выражение константы для которого имеет вид:
Направление смещения равновесия подчиняется принципу Ле-Шателье. 3.3.2.Контрольные задания: 21.Приведите математическое выражение закона действующих масс для реакции 2СО +О2 → 2СО2 и определите, во сколько раз изменится скорость реакции, если увеличить концентрацию оксида углерода (II) в 4 раза, а кислорода уменьшить в 2 раза? 22.Как изменится скорость прямой реакции в системе 2NO(г) + О2(г) = 2NО2(г), если уменьшить объем в 3 раза? Сместится ли при этом равновесие? 23.Приведите выражения для констант равновесия системы СН4(г) + СО2(г) = 2СО(г) + 2Н2(г). В каком направлении произойдет смещение равновесий при повышении давления? Рассчитайте, как изменятся скорости прямой и обратной реакций при увеличении давления в четыре раза? 24.Равновесие в системе Н2(г) + J2(г) = 2HJ(г) установилось при следующих Определите значение константы равновесия и исходные концентрации водорода и йода. 25.Равновесие в гомогенной газовой системе 2А + В Û F + 3D установилось в момент, когда прореагировало 40% вещества А. Вычислить константу равновесия, если исходная концентрация вещества А 1,2моль/л, а вещества В 1,6моль/л. В какую сторону сместится равновесие при увеличении давления? 26.В равновесной системе NiO( т ) + CO( г ) Û Ni( т ) + CO2( г ) с константой равновесия равной 0,8 рассчитайте равновесные концентрации газообразных веществ, если до наступления равновесия в некоторый момент времени концентрации газообразных веществ были одинаковыми и равными 2,2моль/л. 27.Две реакции при 200С протекают с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 3, второй - 4. Найдите соотношение этих скоростей при 80 С. 28.В каком направлении сместится равновесие в системе 2 СО (г) + О2(г) = 2СО2 (г); ∆Н= - 568 кДж при: а) увеличении давления; б) понижении температуры; в) введении дополнительного количества С02? Почему? Какой вид имеет константа равновесия? 28.Какие параметры можно изменить, чтобы добиться смещения равновесия в системе 4НС1(г) + О2(г) = 2С12(г) + 2 Н2О (г); ∆Н= - 116,4 кДж в сторону исходных веществ? Дайте необходимые пояснения и приведите выражение для константы равновесия. 29.Для гетерогенной реакции 3Fe2O3(т) + H2(г)Û 2Fe3O4(т) + H2O(г) с константой равновесия 7,47 и начальной концентрацией водорода 2,1моль/л рассчитайте равновесные концентрации всех газообразных веществ (моль/л). 30.В гомогенной химической реакции 2NO(г) Û O2(г) + N2(г) установилось состояние равновесия с константой равновесия, равной 0,29. Рассчитайте равновесные концентрации всех веществ, если начальная концентрация NO равна 0,8моль/л. Химическая термодинамика Методические указания Этот раздел изучает переходы энергии из одной формы в другую при химических реакциях и устанавливает направление и пределы их самопроизвольного протекания. Тепловые эффекты изобарно-изотермических реакций определяются изменением энтальпии (∆Н х.р.), которые рассчитывают по уравнению: ∆Н х..р. = следствия закона Гесса: тепловой эффект химической реакции (∆Н х..р.) равен сумме энтальпий образования продуктов реакции (∆ 2С6Н6(ж) + 15О2(г) = 12СО2(г) + 6Н2О(ж), ∆Н0обр.=6∆Н0обр(Н2О,ж)+12∆Н0обр(СО2,г)-2∆Н0обр (С6Н6,ж). Величина ∆Н0обр простых веществ, находящихся в термодинамически устойчивых при данных условиях фазовых и агрегатных состояниях, равна нулю. Индекс «О» означает стандартное значение энтальпии. Значение энтропии S характеризует меру неупорядоченности системы. Ее изменение можно рассчитать по уравнению:
В ряде случаев оценить знак изменения энтропии можно, не прибегая к расчетам. Для этого достаточно определить с увеличением или уменьшением объема газообразных веществ протекает реакция. В первом случае DS° > 0. Для изобарно-изотермических процессов возможность самопроизвольного протекания реакции определяется знаком величины изменения энергии Гиббса ∆G0х.р. Если ∆G0х.р. < 0, то данная реакция может самопроизвольно протекать (при Р = const и Т = const). Величину ∆G х.р.можно рассчитать по уравнению:
или на основе значений ∆Н и ∆S: ∆G = ∆H - T∆S. Химическому равновесию отвечает условие ∆G = 0. Равновесию температуру. тогда можно рассчитать по уравнению:
3.4.2. Контрольные задания: 31.Определите ∆Н0298(обр.NH3,г) на основании следующих данных: 4NH3(г) + 3O2(г) = 2N2(г) + 6Н2O(ж);
32 Определите
33.При взаимодействии 4,2 г железа с серой выделилось 7,54 кДж теплоты. Составьте термохимическое уравнение и вычислите 34. Прямая или обратная реакция СН4 (г) + СO2(г) = 2СО (г) + 2Н2(г) будет протекать при стандартных условиях?
35. При какой температуре наступает химическое равновесие в системе
36. Не производя вычислений, установите знак AS0 для следующих процессов: 6) N2 + О2 → 2NO в) 2H2S (г) + 3О2(г) → 2Н2О (ж) +2SО2 (г) г) СО2(к) → СО2(г) 37. Определите, возможно ли самопроизвольное течение реакции РЬ + СuО → Сu + РЬО при стандартных условиях
38. Сформулируйте закон Гесса и его следствия. Прокомментируйте их на конкретных примерах. 39. На основании следующих данных: С(графит) + O2(г) = СO2(г); MgO(к) + CO2(г) = MgCО3(к); 2Mg(к) + О2(г) = 2MgO(к); вычислите 40. Почему невозможны при любых температурах реакции, для которых ∆Н>0, a ∆S<0? При каких температурах (низких или достаточно высоких) возможны реакции с положительными значениями ∆Н, ∆S?
|






 являющимся математическим выражением
являющимся математическим выражением ) за вычетом суммы энтальпий образования исходных веществ (∆Нисх) с учетом стехиометрических коэффициентов. Например, для системы:
) за вычетом суммы энтальпий образования исходных веществ (∆Нисх) с учетом стехиометрических коэффициентов. Например, для системы:

 .
. =-1530 кДж;
=-1530 кДж;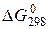 для реакции 2NO + О2 = 2NО2, если
для реакции 2NO + О2 = 2NО2, если (O2)= 205,0 Дж/моль К,
(O2)= 205,0 Дж/моль К,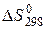 .
. = -114,42 кДж.
= -114,42 кДж.