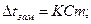ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Растворы. Способы выражения концентрации растворов. Свойства растворов
Методические указания Раствор - это гомогенная, однофазная, многокомпонентная система переменного состава, каждый элемент объёма которой обладает одинаковыми термодинамическими свойствами. Истинные растворы образуют системы с размерами частей менее 1нм. По агрегатному состоянию растворы бывают жидкие, твердые и газообразные. Примером первых могут быть растворы солей в воде, примером вторых - сплав никеля и меди или сплав золота и серебра, примером третьих -смесь газов, воздух. Массовая доля (%) характеризует массу растворенного вещества, которая содержится в 100 г раствора:
Молярная концентрация показывает число молей вещества в 1 л раствора:
Нормальная (эквивалентная) концентрация соответствует числу эквивалентов растворенного вещества в 1л раствора:
Моляльность определяет количество вещества в 1 кг растворителя:
Мольная доля - отношение числа молей данного вещества к общему числу молей всех веществ, содержащихся в растворе:
Растворимость вещества характеризуется концентрацией его насыщенного раствора. Для разбавленных растворов неэлектролитов справедлив ряд законов. 1. Осмотическое давление (Pосм) равно: Росм= 1000СмRT, где R- универсальная газовая постоянная. 2. Относительное понижение давления насыщенного пара растворителя
Повышение температуры кипения и понижения температуры замерзания раствора в сравнении с чистым растворителем пропорциональны моляльной концентрации:
Е- эбуллиоскопическая постоянная (для воды Е = 0,52) К - криоскопическая константа (для воды К = 1,86) Контрольные задания 41.Какую массу нитрата цинка необходимо растворить в воде, чтобы получить 3 л 0,6 М раствора? Какова массовая доля (%) и моляльность этого раствора, если его плотность равна 1,08 г/мл? 42.Какой объем 96% - ного раствора серной кислоты плотностью 1,84 г/мл необходимо использовать для приготовления 400мл 0,5 Н раствора? 43.В какой массе воды нужно растворить 100 г хлорида алюминия, чтобы получить 14%-ный по массе раствор? Какова эквивалентная концентрация этого раствора, если его плотность равна 1,10 г/мл? 44.Сколько граммов хлорида бария содержится в 25мл 0,5 Н раствора? Какова молярная концентрация? 45.Определите температуру кипения 15%-ного раствора пропилового спирта C3H7OH в воде. Эбуллиоскопическая константа воды равна 0,52°С. 46.Чему равно осмотическое давление раствора, содержащего в 400мл 36г глюкозы при температуре 57°С? 47.При какой температуре будет замерзать раствор, содержащий 6,4г метанола и 250г воды? Криоскопическая константа воды равна 1,86°С. 48.Раствор, содержащий 13г некоторого неэлектролита в 400г диэтилового эфира, кипит при температуре 36,441°С. Температура кипения чистого эфира равна 35,60°С. Вычислить молярную массу растворенного вещества, если КЭ эфира равна 2,02оС. 49.Вычислите температуру кипения 4%-ного раствора нафталина С10Н8 в бензоле. Температура кипения бензола равна 80,2°С. Е(бензола)=2,570С. 50.Какой объём этиленгликоля [С2Н4(ОН)2] плотностью 1,1 кг/л необходимо добавить на каждый литр воды, чтобы получить антифриз, замерзающий при температуре -20оС? К(Н2O)=1,86°С . Гидролиз солей Методические указания В химическое взаимодействие с водой не вступают соли, образованные сильной кислотой и сильным основанием, поэтому они не изменяют значение водородного показателя. Если же соль образована слабой кислотой и сильным основанием, то значение рН раствора становится больше 7. Такие соли гидролизуются по аниону. При однозарядном анионе в результате образуется слабая кислота и сильное основание: КАn + Н2O = КОН + KНАn, An- +Н2О = ОН- +НАn. Если анион многозаряден, то процесс гидролиза ступенчатый, но при обычных условиях значения степеней гидролиза для последующих после первой стадий очень незначительны, и ими можно пренебречь: К2Аn + Н2O = КОН + КНАn, An2- +H2O = ОН- + НАn-. Таким образом, реальные продукты - сильное основание и кислая соль. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону, реакция среды - кислая. Если катион однозаряден, то образуется слабое основание и сильная кислота, многозаряден - на первой ступени получается основная соль и сильная кислота: NH4Cl + HOH = NH4OH + HCl, Zn(NO3)2 + НОН = ZnOHNO3 + HNO3 (первая ступень). Соли, образованные слабым основанием и слабой кислотой гидролизуются одновременно по катиону и аниону. Если соль образованна слабым нерастворимым или летучим основанием и аналогичной кислотой, то гидролиз необратим. CH3COONH4 + Н20 = СН3СООН + NH4OH, Al2S3 + 6Н2O = 2 А1(ОН)3↓ + 3H2S. Степень гидролиза повышается с ростом температуры и разбавлением. 3.6.2. Контрольные задания: 51.Какой характер среды имеют растворы ZnCl2, K2SO4, (NH4)2S? Дайте обоснованный ответ с приведением для протекающих реакций гидролиза соответствующих молекулярных и ионных уравнений. 52.Какой характер среды имеют растворы K2S, Co(NО3)2, NaNO3? Дайте обоснованный ответ с приведением для протекающих реакций гидролиза соответствующих молекулярных и ионных уравнений. Как изменится рН раствора КОН при разбавлении его водой? 53.Какой характер среды имеют растворы КNО3, (СН3СОО)2РЬ, Li2CO3? Дайте обоснованный ответ с приведением для протекающих реакций гидролиза соответствующих молекулярных и ионных уравнений. 54.Какой характер среды имеют растворы (NH4)2SО4, K2SO3, NaI? Дайте обоснованный ответ с приведением для протекающих реакций гидролиза соответствующих молекулярных и ионных уравнений. 55.Какой характер среды имеют растворы FeOHCl2, KHS, Li2SO4? Дайте обоснованный ответ с приведением для протекающих реакций гидролиза соответствующих молекулярных и ионных уравнений. Как изменится рН раствора серной кислоты при разбавлении его водой? 56.Расположите вещества в порядке возрастания склонности к гидролизу: Na2SiO3, Сr2(СО3)3, RbNO3. Дайте необходимые пояснения. Приведите соответствующие уравнения гидролиза. 57.Расположите вещества в порядке возрастания склонности к гидролизу: FeSO4, NaNO3, (NH4)2S. Дайте необходимые пояснения. Приведите соответствующие уравнения гидролиза. 58.Водные растворы каких из ниже перечисленных солей будут изменять окраску лакмуса с фиолетового в красный цвет: (NH4)2SO4, K3PO4, Na2SO3, Pb(NO3)2? Напишите соответствующие уравнения гидролиза солей. 59.Водные растворы каких из ниже перечисленных солей будут изменять окраску лакмуса с фиолетового в синий цвет: Na2S, K2SO4, KHSO3, (NH4)2S? Напишите соответствующие уравнения гидролиза солей. 60.Закончите уравнение следующих реакций гидролиза: Cr2(SО4)3 + Na2CO3 + Н2O → А1С13+ Na2S +Н2О → |



 .
. моль/л.
моль/л. моль/л.
моль/л. моль/кг.
моль/кг.