 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Окислительно-восстановительные реакции
Методические указания Реакции, протекающие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ, называют окислительно-восстановительными (ОВР). Степень окисления- это условный заряд атома элемента вмолекуле, приобретенный им за счет смещения электронов от менее электроотрицательного элемента к более электроотрицательному. При определении степени окисления нужно помнить: - степень окисления атома в простом веществе равна 0; - степень окисления атома водорода во всех соединениях, кроме гидридов металлов равна +1; - степень окисления кислорода, кроме пероксидов и OF2, равна -2; - степень окисления атомов элементов I, II, Ш групп главных подгрупп периодической системы равна +1, +2, +3 соответственно; - сумма степеней окисления всех атомов в молекуле равна 0. - сумма степеней окисления всех атомов в ионе равна заряду иона. Окислениемназывают процесс отдачи электронов атомом, молекулой или ионом. Степень окисления при этом повышается: А1-3е- → А13+ Н2 - 2е- → 2Н+ Fe2+ - е- → Fe3+. Восстановлениемназывают процесс присоединения электронов атомом, молекулой, ионом. Степень окисления при этом понижается: S+2e- → S2- Сl2 + 2е- → 2Сl- Fe3+ + е- → Fe2+. Атомы, молекулы или ионы, отдающие электроны, называют восстановителями. Окислителямиже называются атомы, молекулы или ионы, принимающие электроны. Вещества, содержащие атом элемента в низшей степени окисления, являются типичными восстановителями (Н2 типичными окислителями ( В случае промежуточной степени окисления атома вещество проявляет окислительно-восстановительную двойственность ( Для составления уравнений окислительно-восстановительных реакций используют два метода: электронного баланса и электронно-ионный (метод полуреакций). Метод электронного баланса основан на сравнении степеней окисления атомов в исходных и конечных веществах. Число электронов, отданных восстановителем, должно равняться числу электронов, принятых окислителем. Пример. Составьте уравнения реакции взаимодействия сероводорода с перманганатом калия в кислой среде. 1. Запишем схему и расставим степени окисления элементов
2. Составляем электронные уравнения
Расставляем коэффициенты при окислителе и восстановителе, а затем при других веществах. Окончательное уравнение реакции имеет вид:
Метод полуреакций учитывает реальное состояние веществ в растворе. При составлении уравнений методом полуреакций необходимо соблюдать следующие условия: Начинать, как и в случае метода электронного баланса, с составления схемы процесса. Для этого в ионном виде записывают окислитель, восстановитель и продукты их взаимодействия. Напомним, что сильные электролиты записываются в виде ионов, а слабые - в виде молекул. При составлении уравнений полуреакций следует исходить из следующего. Связывание избыточного кислорода производится в кислой среде ионами Н+ с образованием молекул воды, а в нейтральной"и щелочной средах -молекулами воды с образованием ионов ОН-. Недостаток кислорода восполняется в кислой и нейтральной средах молекулами воды с образованием, катионов водорода, а в щелочной - гидроксид-ионами с выделением воды. В качестве примера рассмотрим выше приведенное уравнение реакции:
Сократив на 10Н+, получаем:
Расставляем коэффициенты в основном уравнении: 5H2S + 2KMnО4 + 3H2SО4 = 5S° + 2MnSО4 + K2SО4 + 8H2О.
3.7.2. Контрольные задания: Методом электронного или электронно-ионного баланса расставьте коэффициенты в уравнениях реакций, укажите окислитель и восстановитель, тип окислительно-восстановительной реакции: 61.Fe(NО3)2 + MnО2 + HNО3 → Fe(NO3)3 + Mn(NО3)2 + Н2О S + КОН → K2S + K2SО3 + H2О 62.Pb(NО3)2 →PbO + NО2 + О2 HNO3 + Cu → Cu(NO3)2 + NO2 + H2O 63.Cl2 + Br2 + KOH → KC1 + KBrO3 + H2O Cl2 + KOH → KCI + KClO3 64.H2О2 + HIO3 → I2 + O2 + H2O Br2 + NaOH → NaBr + NaBrO + H2O 65.SO2 + HNO3 + H2O → H2SO4+ NO NH4NО2 → N2 + H2O 66.Na2S2О3 + Br2 + NaOH → NaBr + Na2SO4 + H2O NaNO3 → NaNO2 + O2 67.NaI + KMnO4 + KOH → I2 + K2MnO4 + NaOH Cu(NО3)2 → CuO + NO2 + O2 68.HI + H2SО4 → I2 + H2S + H2O HNO2 → HNО3+NO + H2O 69.HC1 + KMnO4 → MnCl2 + Cl2 + KCI + H2O KClO3 → KCI + O2 70.SnCl2+K2Cr2O7 + H2SO4 → Sn(SO4)2 + SnCl4 + Cr2(SO4)3 + K2SO4 + H2O Na2SO3 → Na2S + Na2SO4 |



 ,
,  ,
,  ); в высшей -
); в высшей - ,
,  ).
).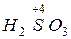 ,
, 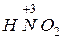 и т.п.).
и т.п.).



 .
.



