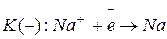ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Электродные потенциалы. Гальванические элементы, аккумуляторы
Методические указания Гальваническими элементами называют устройства, в которых энергия химической реакции преобразуется в электрическую. Основу работы любого гальванического элемента составляют окислительно-восстановительные процессы, причем реакции окисления и восстановления, протекающие на электродах, пространственно разделены. Тот электрод, на котором происходит процесс окисления, называется анодом, восстановления - катодом. Значение электродного потенциала катода (Ек) для работающего гальванического элемента положительнее, чем у анода (ЕА). Каждый из электродов помещен в свое электродное пространство, содержащее ионный проводник. Движение ионов из одного электродного пространства в другое возможно за счет наличия пор в перегородке или солевого мостика, при этом непосредственного перемешивания ионных проводников не происходит. Электродвижущая сила (ЭДС) элемента определяется разностью потенциалов катода и анода: ЭДС = ЕК- ЕА. Значение величины электродного потенциала зависит от ряда факторов и рассчитывается по уравнению Нернста:
где п - число электронов, участвующих в процессе; Е° - стандартная величина электродного потенциала, т.е. потенциал электрода при концентрациях окисленных и восстановленных форм, равных единице; R - универсальная газовая постоянная (8,31 F - число Фарадея (96500 Т - абсолютная температура; [ок.] и [восст.] - произведения концентраций окисленных и восстановленных форм, соответственно. Если одна из форм находится в виде газа, то вместо концентрации используют парциальное давление. Например, на водородном электроде протекает процесс:
тогда Концентрации твердых тел и воды (для водных растворов) считают величинами постоянными. Поэтому для полуреакции:
а для полуреакции
При подстановке в уравнение Нернста значений констант оно принимает вид:
а при работе элемента в нормальных условиях (Т = 298 К) преобразуется в выражение:
Тогда для любого металлического электрода, опущенного в раствор его соли, значение потенциала Одними из наиболее простых гальванических элементов являются устройства из двух металлических электродов, помещенных в растворы своих солей. Таким является, например, прибор из пластин никеля в 1 М растворе NiSO4 и серебра в 0,1 М растворе AgNO3.
Так как
Электроны при замыкании внешней цепи движутся от никеля к серебру. Схема данного гальванического элемента имеет следующий вид: А (-) Ni | NiSO4| | AgNO3 | Ag (+) K. Гальванический элемент может работать, если он составлен из одинаковых электродов, погруженных в растворы одного и того же электролита, но с разной концентрацией (концентрационный гальванический элемент). Для них значение ЭДС можно рассчитать по формуле:
А(-)металл | электролит(C1)||электролит(С2)|металл (+)К С1< С2. 3.8.2. Контрольные задания: 71. Рассчитайте значения 1,0; 0,1; 0,001 моль/л. Сделайте вывод об изменении значения электродного потенциала с разбавлением. 72.ЭДС гальванического элемента, составленного из, медного электрода (катод), опущенного в раствор CuSO4 с концентрацией 0,01 моль/л, и электрода из неизвестного металла, опущенного в раствор с [Ме2+]=1моль/л, равна 0,532 В. Какой это металл? 73.Гальванический элемент состоит из металлического цинка, погруженного в 0,1 М раствор Zn(NO3)2 и металлического свинца, погруженного в 0,01 М раствор Pb(NO3)2. Вычислите ЭДС элемента, составьте его схему. 74.Гальванический элемент состоит из двух серебряных электродов, опущенных в растворы AgNO3. ЭДС этого элемента равна 0,118В. Концентрация AgNO3 у одного электрода (катода) равна 0,05 моль/л. Чему равна концентрация AgNO3 у другого электрода? 75.Вычислите ЭДС гальванического элемента, образованного двумя никелевыми электродами, находящимися в растворах NiSO4 с концентрациями 0,01 и 0,0001 моль/л. Как называются элементы такого типа? 76.Составьте схему гальванического элемента, составленного из кобальтовой и железной пластин, опущенных в раствор их сульфатов. Вычислите ЭДС этого элемента, если [CoSO4]=0,01 моль/л, a [FeSO4]=0,0001 моль/л. 77.Вычислите ЭДС гальванического элемента, состоящего из медной и магниевой пластин, опущенных в растворы своих солей с концентрацией [Cu2+]=[Mg2+]=0,01 моль/л. 78.При какой концентрации ионов Сu2+ значение медного электрода становится равным 0,224 В? 79.Опишите принцип работы и приведите уравнения процессов, протекающих при разрядке и зарядке свинцового кислотного аккумулятора. 80.Опишите принцип работы и приведите уравнения процессов, протекающих, при разрядке и зарядке никелевого щелочного аккумулятора. Электролиз Методические указания Электролизом называется совокупность процессов, протекающих при прохождении постоянного электрического тока через электрохимическую систему, состоящую из электродов и раствора или расплава электролита. При электролизе происходит превращение электрической энергии в химическую. Наиболее простым случаем является электролиз расплавов с инертным (нерастворимым анодом). Суть процесса при этом заключается в окислительно-восстановительных превращениях ионов, образующихся при диссоциации электролита. Пример 1. Электролиз расплава NaCl.
Пример 2. Электролиз расплава КОН КОН = К+ + ОН- 4ОН-- + 4К+ электролиз à О2 + 2Н2О + 4К 4КОН электролиз à 02 + 2Н2О + 4К. При электролизе водных растворов необходимо учитывать в первую очередь возможность протекания процессов окисления и восстановления воды, а также явление перенапряжения (изменение потенциала в ходе электрохимической реакции). Из различных возможных процессов на аноде наиболее вероятен тот, потенциал окисления которого минимален, а на катоде -потенциал восстановления которого максимален. Пример 3. Электролиз раствора CuSО4 с угольным (нерастворимым) анодом. CuSО4 = Cu2++SO42--. Можно предположить следующие процессы окисления: а) 2SO4 2- - 2е = S2O2—8 (E°s2o8-2/2SO42- = 2,01 В); б) 2Н2О - 4ё = О2 + 4Н+ (Е0О2/2H2O = 1,23 В). Так как Е0О2/2H2O значительно меньше E°s2o8-2/2SO42- , то на аноде наиболее вероятен процесс окисления воды. Теоретически возможные процессы восстановления на катоде: а) Сu2+ + 2ё = Сu0 (Е°Cu2+ /Cu = 0,34 В); б) 2Н2О + 2e = Н2 + 2ОН- (Е°2н2о/н2 = -0,41 В). Так как Е°Cu2+/Сu значительно больше Е°н2о/н2, то практически на катоде протекает восстановление ионов меди. Таким образом, реально протекающие процессы на электродах имеют вид: А(+) : 2Н2О - 4ё à О2 + 4Н+ 1 К (-) : Cu2+ + 2ё à Си 2 2Н2О + 2Сu2+ электролизà О2 + 4Н+ + 2Сu С учетом имеющихся в растворе сульфат-ионов перейдем от сокращенного ионного уравнения к полному ионному, а затем к молекулярному: 2Н2О + 2Cu2+ + 2SО2-- электролиз àO2 + 4Н+ + 2SO42-- + 2Cu2+ 2Н2О + 2CuSО4 электролизà О2 + 2H2SО4 + 2Cu Итак, на аноде выделяется газообразный кислород, в прианодном пространстве накапливается раствор серной кислоты (вторичный продукт электролиза), а на катоде осаждается медь. Для качественного предсказания результатов электролиза можно исходить из следующего: - при электролизе водных растворов бескислородных кислот и их солей (кроме HF и фторидов) у анода разряжаются анионы этих солей; - при электролизе кислородсодержащих кислот и их солей, HF и фторидов на аноде происходит окисление молекул воды или ионов ОН" с выделением кислорода; - на катоде будет восстанавливаться металл, если он в ряду напряжений находится от" олова и далее; - на катоде будет происходить восстановление молекул воды, если металл в ряду напряжений стоит до алюминия включительно; - если металл находится в средней части ряда напряжений (от А1 до Sn), то возможно как восстановление катиона металла, так и восстановление молекул воды. Пример 4: Электролиз раствора Pb(N03)2 Pb(NО3)2 ó Pb2+ + 2NO3-;.
2Н20 + 2Рb2+ 2Н20 + 2Рb2+ + 4 NO3- 2 Н20 + 2Pb(NO3)2 электролизà 02 + 4 HN03 + 2Рb. Продукты электролиза - металлический свинец и газообразный кислород. В прианодном пространстве накапливается раствор азотной кислоты. Пример 5: Электролиз раствора NiCl2. NiCl2 ó Ni2+ + 2С1- Некислородсодержащийся хлорид-ион окисляется на аноде. Так как никель находится в средней части ряда напряжений, то, в зависимости от условий электролиза, возможно как восстановление ионов Ni2+, так и молекул воды. Эти процессы могут протекать и параллельно. А(+): 2С1- - 2ё = С12 К(-): a) Ni2+ + 2e = Ni° б) 2Н2O + 2ё = Н2 + 2OH-. В таких случаях суммарное уравнение не составляется. Однако, не во всех случаях, электродные потенциалы окисления материала анода значительно выше Е0О2/2H2О , т.е. аноды являются нерастворимыми (из графита, платиновых металлов,- золота, специальных сортов нержавеющей стали). Электролиз с использованием растворимых анодов (медь, цинк, кадмий, никель и др.) является наиболее сложным. Пример 6: Электролиз раствора CuS04 с медным анодом А (+): Сu - 2ё = Сu2+ К(-): Сu2+ + 2ё = Сu° Сu + Сu2+ = Сu2+ + Сu° Масса вещества (т), выделяющаяся на электродах, пропорциональна количеству электричества, прошедшего через раствор электролита (закон Фарадея): Мэ.Q т = ------- , F где Mэ -молярная масса эквивалента вещества, г/моль; Q - количество электричества, кулон (Q = I(a) tc); F- число Фарадея (96500 Кл/моль). 3.9.2. Контрольные задания: 81.Какая масса металла осаждается на катоде при электролизе раствора сульфата кадмия силой тока 0.9 А в течение 20 минут? Выход по току 100%. Напишите уравнения анодной и катодной реакций, если анод – платина. 82.При электролизе раствора током силой 0.7 А в течение 30 минут на катоде выделилось 1.35 г металла. Вычислить эквивалентную массу этого металла, приняв выход по току 100%. Идентифицируйте этот металл. 83.При электролизе водного раствора хлорида кальция на одном из угольных электродов выделилось 14,2 г хлора. Какой газ и в каком объеме выделился на другом электроде? 84.При электролизе раствора сульфата кобальта с кобальтовым анодом током силой 1.4А в течение 36 минут на катоде выделилось 0.8 г металла. Определите катодный выход по току. 85.Какова молярная концентрация раствора нитрата свинца, если для выделения всего металла из объёма 75 мл этого раствора потребовалось пропустить ток силой 0.8А в течение 24 минут? 86.Вычислите массу металла, выделившего на катоде и объем газа, образовавшегося на аноде при пропускании тока сильной 5 А через раствор нитрата меди (II) в течении 30 минут. 87.При электролизе соли некоторого двухвалентного металла в течение 1,0 часа при силе тока 1,5 А выделилось 1,8 г этого металла. Что это за металл? 88.Через раствор гидроксида калия пропустили ток силой 7А в течение 28 минут. Какие вещества выделяются на платиновых электродах и каков их объём (н.у.)? Выход по току катодного и анодного процессов принять 100%. Приведите уравнения реакций. 89.Какова должна быть сила тока, чтобы при электролизе раствора нитрата ртути в течение 22 минут на катоде выделилось 1.95 г металла при выходе по току 100%? Напишите уравнения реакций. 90.При электролизе раствора нитрата меди на графитовых электродах в течение 45 минут и силе тока 6А выделилось 0.8 литров газа при н.у. Определить выход по току.
|



 ,
, );
); );
); ;
; .
.
 ,
,
 .
. ,
, .
.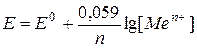 или
или  , где С — концентрация ионов металла, моль/л.
, где С — концентрация ионов металла, моль/л.

 , то серебро является катодом, а никель - анодом.
, то серебро является катодом, а никель - анодом.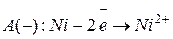


 , а схема имеет вид:
, а схема имеет вид: при концентрациях Mg2+ равных
при концентрациях Mg2+ равных ;
;