 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| г) збільшення розчинності газів при зменшенні тиску і зменшення розчинності газів в крові при зменшенні тиску.
1.7.7. Осмосом називається процес переходу через напівпроникну мембрану молекул розчинника: а) із 2 % р-ну NaClв 10 % р-н NaCl; б) із 10 % р-ну NaCl в 2 % р-н NaCl; в) із 5 % р-ну NaCl в 5 % р-н NaCl; г) із 10 % р-ну NaCl в 10 % р-н NaCl; д) із 0,9 % р-ну NaCl в 5 % р-н глюкози.
1.7.8. Осмотичний тиск вимірюється в: а) кПа; б) кДж/моль; в) Па/л; г) атм/моль; д) Па/моль.
1.7.9. Осмотичний тиск плазми крові рівний: а) 740-780 кПа; б) 730-750 кПа; в) 800-850 кПа; г) 700-800 кПа; д) 720-760 кПа.
1.7.8. Ізотонічним називається розчин, що має значення осмотичного тиску: а) рівний значення стандарту; б) вищий значенню стандарту; в) нищий значення стандарту; г) нижчий значення тиску крові; д) вищий значенню тиску крові;
1.7.9. Ізотонічним до плазми крові є розчин: а) 4,5 %-ий глюкози; б) 4,5 %-ий NaCl; в) 0,45 %-ий глюкози; г) 0,9 %-ий глюкози.
1.7.10. Гіпотонічним називається розчин, що має значення осмотичного тиску: а) рівний значення стандарту; б) вищий значенню стандарту; в) нищий значення стандарту; г) нижчий значення тиску крові; д) вищий значенню тиску крові;
1.7.11. Гіпертонічним називається розчин, що має значення осмотичного тиску: а) рівний значення стандарту; б) вищий значенню стандарту; в) нищий значення стандарту; г) нижчий значення тиску крові; д) вищий значенню тиску крові;
1.7.12. Із наведених нижче розчинів гіпертонічним є: а) 5 % р-н глюкози; б) 0,1 % NaCl; в) 1,0 % р-н глюкози; г) 10 % NaCl.
1.7.13. Еритроцит вміщений в 0,5 % розчин NaCl. При цьому протікає процес: а) гемолізу; б) плазмолізу; в) екзоосмосу; г) дифузії;
1.7.14. Еритроцит вміщений в 0,9 % розчин NaCl. При цьому протікає процес: а) гемолізу; б) плазмолізу; в) екзоосмосу; г) дифузії;
1.7.15. Еритроцит вміщений в 5 % розчин NaCl. При цьому протікає процес: а) гемолізу; б) плазмолізу; в) ендоосмосу; г) дифузії;
1.7.16. Еритроцит вміщений в 10 % розчин NaCl. При цьому протікає процес: а) гемолізу; б) плазмолізу; в) ендоосмосу; г) дифузії;
1.7.17. Еритроцит вміщений в 0,9 % розчин глюкози. При цьому протікає процес: а) гемолізу; б) плазмолізу; в) екзоосмосу; г) дифузії;
1.7.18. Еритроцит вміщений в 5 % розчин глюкози. При цьому протікає процес: а) гемолізу; б) плазмолізу; в) ендоосмосу; г) дифузії;
1.7.19. Еритроцит помістили в дистильовану воду. При цьому відбуваються процеси: а) набухання і розтріскування; б) всихання і зморщування; в) нічого не відбувається; г) поглинання води еритроцитом; д) виділення води еритроцитом.
1.7.20. Еритроцит помістили в 2% розчин CuCl2. При цьому відбуваються процеси: а) набухання: розтріскування; б) всихання і зморщування; в) нічого не відбувається; г) поглинання води еритроцитом; д) виділення води еритроцитом.
1.7.21. Порівняйте осмотичний тиск розчинів NaCl і глюкози однаковї молярної концентрації: а) більший в NaCl; б) менший в NaCl; в) однакові; г) менший в глюкози; д) більший в глюкози.
1.7.22.В 1 л розчину, який ізотонічний до плазми крові може бути глюкози: а) 0,303 моля; б) 0,205 моля; в) 0,154 моля; г) 0,148 моля; д) 0,284 моля.
1.7.23. Порівняйте осмотичний тиск розчинів MgCl2 і NaCl однакових молярних концентрацій: а) більший в MgCl2; б) більший в AgCl; в) менший в MgCl2; г) однаковий; д) менший в AgCl.
1.7.24. Порівняйте осмотичний тиск розчинів сахарози і Na3PO3 однакових молярних концентрацій: а) більший в сахарозі; б) однаковий; в) більший в Na3PO3; г) менший в сахарозі; д) менший в Na3PO3. 1.7.25. Порівняйте осмотичний тиск розчинів NaBr і NaCl однакових молярних концентрацій: а) більший в NaBr; б) однаковий; в) менший в NaBr; г) більший в NaCl; д) менший в NaCl.
1.7.26. Температура замерзання розчину в порівнянні із температурою замерзання чистого розчинника: а) понижується; б) підвищується; в) не змінюється; г) понижується, а потім підвищується; д) підвищується, а потім понижується.
1.7.27. Температура кипіння розчину в порівнянні із температурою кипіння чистого розчинника: а) понижується; б) підвищується; в) не змінюється; г) понижується, а потім підвищується; д) підвищується, а потім понижується.
1.7.28. Депресією температури замерзання розчину називають: а) пониження температури замерзання; б) підвищення температури замерзання; в) пониження тиску; г) підвищення тиску; д) зміна температури.
1.7.29. Визначення молярної маси розчиненого у воді неелектроліту через визначення температури замерзання його розчину називається: а) кріометрією; б) ебуліометрією; в) кріоскопією; г) осмометрією.
1.7.30. Визначення молярної маси розчиненого у воді неелектроліту через визначення температури кипіння його розчину називається: а) кріометрією; б) ебуліоскопією; в) кріоскопією; г) осмометрією.
1.7.31. Кількісно величину осмотичного тиску розчиненого у воді неелектроліту можна визначити законом Вант-Гоффа за формулою: а) π=CRT б) π=iCRT в) Δp=po x2 г)
1.7.32. Кількісно величину осмотичного тиску розчиненого у воді електроліту можна визначити законом Вант-Гоффа за формулою: а) π=CRT б) π=iCRT в) Δp=po x2 г)
1.7.33. Кріоскопічна постійна К визначається як величина пониження температури замерзання розчину, що містить: а) 1 моль розчиненої речовини в 1 кг розчинника; б) 1 моль розчиненої речовини в 1 л розчинника; в) 0,1 моль розчиненої речовини в 1 кг розчинника; г) 1 моль розчиненої речовини в 100 г розчину; д) 0,1 моль розчиненої речовини в 1 кг розчину. ІІ рівень 2.7.1. Осмотичний тиск розчину гемоглобіну в воді, яка містить 124 г/л речовини при 170 С дорівнює 4,40 кПа. Молярна маса гемоглобіну, розрахована методом осмометрії рівна: 2.7.2. 1 літр розчину містить 18,4 г гліцерину. Осмотичний тиск такого розчину при 250С рівний: 2.7.3. На основі закону Вант-Гоффа розрахуйте осмотичний тиск 5% розчину глюкози при 370С: 2.7.4. На основі закону Вант-Гоффа розрахуйте осмотичний тиск 0,2% розчину NaCl при 370С: 3.7.5. На основі закону Вант-Гоффа розрахуйте осмотичний тиск 0,9% розчину NaCl при 250С: 2.7.6. На основі закону Вант-Гоффа розрахуйте осмотичний тиск 10% розчину NaCl при 370С:: 2.7.7. На основі закону Вант-Гоффа розрахуйте осмотичний тиск 10% розчину глюкози при 370С: 2.7.8. На основі закону Вант-Гоффа розрахуйте осмотичний тиск 0,9% розчину глюкози при 370С: 2.7.9. На основі закону Вант-Гоффа розрахуйте осмотичний тиск 4,5% розчину глюкози при 370С: 2.7.10. Розчин сахарози при 2750 К має осмотичний тиск 354,55 кПа. Скільки грамів сахарози знаходиться в 1 л розчину? 2.7.11. Розчин глюкози при 3100 К має осмотичний тиск 740 кПа. Скільки г глюкози міститься в 1 л розчину? 2.7.12. Розчин NaOH при 250 К має осмотичний тиск 750 кПа. Скільки г NaOH міститься в 1 л розчину? 2.7.13. Скільки молей електроліту знаходиться в 1 л розчину, якщо його осмотичний тиск при 2750 К 750 кПа? 2.7.14. Розчин NaCl при 298 К має осмотичний тиск 380 кПа. Скільки грамів солі міститься в 1 л розчину? 2.7.15. Розчин NaCl при 310 К має осмотичний тиск 750 кПа. Скільки грамів солі міститься в 200 г такого розчину? 2.7.16. Обчислити осмотичний тиск розчину гемоглобіну при температурі 300К, якщо в 1л розчину міститься 124г гемоглобіну, враховуючи, що макромолекула гемоглобіну має глобулярну форму. R=8,31·103л·Па/моль·К; М(гемоглобіну)=68000г/моль. 2.7.17. Розрахувати молярну масу неелектроліту, якщо при розчиненні 2,3г цієї речовини у воді, одержали 250 мл розчину, осмотичний тиск якого при 270С дорівнює 249 кПа. R=8,31·103л·Па/моль·К. 2.7.18. Розрахувати величину осмотичного тиску розчину, що містить 9,2г гліцерину (С3Н8О3) в 100мл розчину при 25°С. R=8,31·103л·Па/моль·К. ТЕРМОДИНАМІКА 1.6.1. Параметри стану системи: а) температура, тиск, об’єм, концентрація; б) температура, ентальпія, ентропія, об’єм; в) температура, концентрація, внутрішня енергія, вільна енергія; г) тиск, концентрація, ентропія.
1.6.2. Функції стану системи: а) внутрішня енергія, ентальпія, ентропія, вільна енергія; б) внутрішня енергія, ентропія, температура, тиск; в) ентропія, ентальпія, енергія Гіббса, температура; г) внутрішня енергія, тиск, ізобарно-ізотермічний потенціал, ентропія.
1.6.3. Тепловий ефект хімічних реакцій: а) кількість тепла, що виділяється чи поглинається при протіканні хімічної реакції; б) кількість тепла, що виділяється при протіканні хімічної реакції; в) кількість тепла, що поглинається при протіканні хімічної реакції; г) кількість тепла, що затрачається на роботу.
1.6.4. Ізобарно-ізотермічний потенціал (енергія Гіббса) показує, що реакція може самовільно протікати в сторону утворення продуктів реакції, якщо: а) DG<0; б) DG>0; в) DG=0; г) DН<0.
1.6.5. Стандартні умови визначаються наступними значеннями тиску і температури: а) 101,3 кПа, 273 К; б) 101,3 кПа, 298 К; в) 101,3 кПа, О К; г) 100,0 кПа, 273 К; д) 100,0 кПа, 298 К.
1.6.5. Для яких речовин стандартні теплоти утворення (АН°298) рівні нулю: а)СО2; б)Н2О; в) Н2; г) CO; д) О3.
1.6.6. При складанні теплових балансів хімічних процесів часто неможливо експериментальне визначити тепловий ефект процесу. В цьому випадку для розрахунків застосовують закон: а) Нернста; б) Рауля; в) Гесса; г) Фарадея; д) Вант-Гоффа.
1.6.7. За ізобарно-ізотермічних умов критерієм напрямку реакції є зниження: а) енергії Гельмгольца; б) енергії Гіббса; в) внутрішньої енергії; г) ентропії; д) ентальпії процесу.
1.6.8. Ентропія, як одна з основних термодинамічних функцій, є мірою: а) внутрішньої енергії системи; б) повної енергії системи; в) енергії, яку не можна використати для виконання роботи; г) енергія, яку можна використати для виконання роботи; д) ентальпії.
1.6.9. Закон Гесса встановлює, що тепловий ефект хімічної реакції: а) залежить від природи вихідних речовин; б) залежить від природи продуктів речовин; в) не залежить від природи вихідних речовин; г) не залежить від природи продуктів речовин; д) залежить від шляху перебігу реакції.
1.6.10. Ентропія ідеально утвореного кристалу індивідуальної речовини при абсолютному нулі: а) дорівнює одиниці; б) дорівнює нулю; в) від'ємна; г) мінімальна; д) максимальна.
1.6.11. Яка термодинамічна функція є критерієм самочинного перебігу реакції в закритому автоклаві при сталому тиску: а) енергія Гіббса; б) енергія Гельмгольца; в) внутрішня енергія; г) ентальпія; д) ентропія.
1.6.12 При сталому тиску і сталій температурі критерієм самочинного перебігу реакції є: а) ентальпія; б) ентропія; в) енергія Гіббса; г) внутрішня енергія; д) енергія Гельмгольца.
1.6.13. Критерієм напрямку фізико-хімічних процесів є зменшення енергії Гіббса. При яких сталих факторах цей параметр дійсний: а) температури і об'єму; б) температури і тиску; в) маси і теплоємності; г) тиску і об'єму; д) температури і маси.
1.6.14 Часто неможливо визначити тепловий ефект процесу. В такому випадку для розрахунку застосовують закон: а) Вант-Гоффа; б) Гесса; в) Нернста; г) Рауля; д) Фарадея.
1.6.15 Ентропія системи зменшується в процесі: а) полімеризації; б) плавлення; в) випаровування; г) сублімації; д) дисоціації.
1.6.16 Енергія Гіббса є мірою: а) внутрішньої енергії системи; б) ентальпії; в) енергії, яку можна використати для використання роботи; г) повної енергії; д) розсіяної енергії. 1.6.17. Для закритої системи термодинамічної системи перший закон термодинаміки має вираз: a) ∆U = Q; б) ∆U = -A; в) ∆U = 0; г) Q =∆U + А ; д) ∆U = Q + А.
1.6.18. При яких значеннях термодинамічних функцій можна визначити рівноважну температуру процесу: а) ∆Н° = 0; б) ∆S° = 0; в) ∆G0 = 0; г) ∆Н° = 0 і ∆S° = 0;
1.6.19. Обов'язковою умовою самочинного протікання процесу є: а) ∆Н°>0; б) ∆Н°<0; в) ∆S° > 0; г) ∆S° < 0; д) ∆G0 < 0.
1.6.20. Для рівноважних хімічних процесів характерним є таке значення термодинамічних функцій: а) ∆Н°>0; б) ∆S°<0; в) ∆Н° = 0; г) ∆G° = 0; д) ∆S° > 0.
1.6.21. При стандартних умовах одиницею вимірювання ентальпії є: а) кДж/моль; б) Дж/моль; в) Дж/моль-К; г) Дж/моль-м2; д) кДж/моль-кал.
1.6.22. В якому з наведених нижче значень реакція можлива при будь якій температурі: а) ∆Н > 0, ∆G > О, ∆S > 0; б) ∆Н < 0, ∆G > 0, ∆S < 0; в) ∆Н < 0, ∆G < 0, ∆S > 0; г) ∆Н > 0, ∆G > О, ∆S < 0; д) ∆Н > 0, ∆G < 0, ∆S > 0.
1.6.23. В якому з наведених нижче значень реакція не можлива при будь якій температурі: а) ∆Н > 0, ∆G > 0, ∆S > 0; б) ∆Н < 0, ∆G > 0, ∆S < 0; в) ∆Н < 0, ∆G < 0, ∆S > 0; г) ∆Н > 0, ∆G > 0, ∆S < 0; д) ∆Н > 0, ∆G < 0, ∆S > 0.
1.6.24. Ентальпія – це: а) термодинамічна функція, що чисельно характеризує міру перетворення енергії в тепло; б) функція стану чисельно рівна сумі внутрішньої роботи системи і енергії роботи по зміні об’єму системи; в) це зміна внутрішньої енергії системи, що виражає її тепловміст; г) параметр стану системи, що виражає зміну внутрішньої енергії системи; 1.6.25. Перший закон термодинаміки: а) закон збереження енергії; б) всі види енергії переходять один в одного в еквівалентних кількостях; в) теплота витрачається на зміну внутрішньої енергії системи; г) теплота витрачається на виконання роботи проти зовнішніх сил. 1.6.26. Параметри стану системи: а) температура, тиск, об’єм, концентрація; б) температура, ентальпія, ентропія, об’єм; в) температура, концентрація, внутрішня енергія, вільна енергія; г) тиск, концентрація, ентропія. 1.6.27. Функції стану системи: а) внутрішня енергія, ентальпія, ентропія, вільна енергія; б) внутрішня енергія, ентропія, температура, тиск; в) ентропія, ентальтилопія, енергія Гіббса, температура; г) внутрішня енергія, тиск, ізобарно-ізотермічний потенціал, ентропія. 1.6.28. Тепловий ефект хімічних реакцій: а) кількість тепла, що виділяється чи поглинається при протіканні хімічної реакції; б) кількість тепла, що виділяється при протіканні хімічної реакції; в) кількість тепла, що поглинається при протіканні хімічної реакції; г) кількість тепла, що затрачається на роботу. 1.6.29. Ентропія – це: а) міра імовірності і функція стану системи; б) міра хаотичності частинок речовин; в) частина енергії, що не може бути перетворена в роботу; г) все разом. 1.6.30. Ізобарно-ізотермічний потенціал (енергія Гіббса) показує, що реакція може самовільно протікати в сторону утворення продуктів реакції, якщо: а) DG<0; б) DG>0; в) DG=0; г) DН<0. 1.6.31. Закон Гесса: а) Сумарний силовий ефект визначається початковим і кінцевим енергетичним станом речовин і не залежить від шляхів переходу або проміжних стадій; б) Сумарний силовий ефект визначається початковим і кінцевим енергетичним станом речовин і залежить від шляхів переходу або проміжних стадій; в) тепловий ефект реакції визначається кількістю теплоти, що виділяється в результаті реакції; г) тепловий ефект реакції визначається кількістю теплоти, що поглинається в результаті реакції. 16.32. Живий організм – це термодинамічна система: а) ізольована, гетерогенна; б) закрита, гомогенна; в) відкрита, гетерогенна; г) відкрита, гомогенна. 1.6.33. Абсолютний запас внутрішньої енергії системи: а) неможливо визначити; б) визначається як сума всіх видів енергії; в) визначається за температурою системи; г) визначається як різниця всіх видів енергії. 1.6.34. Процес, який відбувається за сталої температури: а) круговий; б) ізотермічний; в) ізобарний; г) ізохорний. 1.6.35. Процес, який відбувається за сталого тиску: а) круговий; б) ізотермічний; в) ізобарний; г) ізохорний. 1.6.36. Процес, який відбувається при постійному об’ємі системи: а) круговий; б) ізотермічний; в) ізобарний; г) ізохорний. 1.6.37. Математичний вираз 1 закону термодинаміки: а) Q = ∆U + A; б) ∆U = U2 – U1; в) A = p∆V; г) Q = A - p∆V. 1.6.38. Стандартне значення ентальпії реакції (∆Н298) можна розрахувати: а) Як різницю стандартних значень кінцевих продуктів реакції і вхідних; б) як суму стандартних значень кінцевих продуктів реакції і вхідних; в) Як різницю стандартних значень кінцевих продуктів реакції і вихідних речовин; г) як суму стандартних значень кінцевих продуктів реакції і вихідних речовин. 1.6.39. Значення ентальпії чисельно визначається рівнянням: а) Н = U + pV; б) ∆U = U2 – U1; в) Q = ∆U + A; г) ∆H = H2 – H1. 1.6.40. Тепловий ефект хімічної реакції називають: а) ентальпією; б) ентропією; в) ізоберно-ізотермічним потенціалом; г) внутрішньою енергією.
ІІ рівень 2.6.1. Розрахувати калорійність 200г молока, яке вміщує 3,2% жирів, 5,5% вуглеводів, та 26,6% білків, якщо ∆Нзгор(жирів) = -39,9 кДж/г, а ∆Нзгор (білків) = -17,6 кДж/г. ∆Н°згор(вуглеводів) = -19,6 кДж/г. 2.6.2. Розрахувати можливість самодовільного процесу при Т°=298К, якщо ∆Н0 =300 кДж, ∆S° = 26Дж/К. 2.6.3. Розрахувати калорійність 100г бісквіту, у якому ω(вуглеводів)= 23%, ω(жирів)=15% та 36% білків, якщо калорійність їх відповідно становить 19,6 кДж/г, 38,9 кДж/г та 17,6 кДж/г. 2.6.4. Окиснення етилового спирту в організмі людини проходить через стадію утворення оцтового альдегіду з подальшим окисленням його до оцтової кислоти. Розрахуйте ∆H реакції окиснення етанолу до оцтової кислоти, використовуючи наслідок із закону Гесса. 2.6.5. Обчислити ентальпію (∆Н298) реакції і зробити висновок про тепловий ефект реакції: 2Н2 + О2 = 2Н2О(г) 2.6.6. Обчислити ентропію хімічної реакції і зробити висновок про імовірність даного процесу: 2Н2 + О2 = 2Н2О(г) 2.6.7. Визначити енергію Гіббса для реакції і визначити можливість самовільного протікання процесу при стандартних умовах: 2Н2 + О2 = 2Н2О(г) 2.6.8. Обчислити ентальпію (∆Н298) реакції і зробити висновок про тепловий ефект реакції: 4NH3 + 3 O2 =2N2 + 6H2O
2.6.9. Обчислити ентропію хімічної реакції і зробити висновок про імовірність даного процесу: 4NH3 + 3 O2 =2N2 + 6H2O 2.6.10. Визначити енергію Гіббса для реакції і визначити можливість самовільного протікання процесу при стандартних умовах: 4NH3 + 3 O2 =2N2 + 6H2O 2.6.11. Визначте скільки енергії може виділитись в організмі людини при окисленні 5г цукру. 2.6.12. Для нормальної діяльності студента необхідно затратити 12500-15000 кДж (3000- 3600ккал) енергії. Розрахуйте в якій кількості цукру міститься необхідна кількість енергії? 2.6.13. Обчислити ентальпію реакції і зробити висновок про тепловий ефект реакції: С +О2 =СО2 2.6.14. Обчислити ентропію хімічної реакції і зробити висновок про імовірність даного процесу: С+О2 =СО2 2.6.15. Визначити енергію Гіббса для реакції і визначити можливість самовільного протікання процесу при стандартних умовах: С +О2 =СО2 2.6.16. Для нормальної діяльності студента необхідно затратити 12500-15000 кДж (3000- 3600ккал) енергії. Розрахуйте в якій кількості хліба міститься необхідна кількість енергії? 2.6.17. озрахуйте скільки теплоти виділиться при взаємодії 1 моля гідроксиду кальцію з надлишком фосфатної кислоти. 2.6.18. Розрахуйте ∆Н і ∆S реакції і визначити чи може в стандартних умовах протікати в прямому напрямку реакція: 2СО + О2 = 2СО2 КІНЕТИКА
1.8.1. Яке з наведених нижче рівнянь визначення швидкості є правильним для реакції: А+2В=АВ2? а) v = k∙∙ [А] ∙ [В] б) v = k ∙ [A]2 ∙ [B] в)v = k ∙ [A] ∙ [B]2 г)v = k ∙ [A]2 ∙ [B]2 .
1.8.2. Чи зміниться стан хімічної рівноваги в наведеному рівнянні при зниженні температури: N2+3H2↔2NH3+Q? а) не зміниться; б) зміститься вправо; в) зміститься вліво; г)температура не впливає на стан рівноваги цього процесу.
1.8.3. Як зміниться стан хімічної рівноваги при підвищенні тиску такого процесу: 2NO+O2 ↔2NO2, ∆Н=-78кДж/моль? а) не зміниться; б) прискориться прямий процес; в) прискориться зворотній процес; г) спочатку зменшиться швидкість прямого процесу, а потім збільшиться.
1.8.4. У реакції С(т)+О2(г)=СО2(г) тиск збільшили в 4 рази. Як зміниться при цьому вихід СО2? а) зросте в 4 рази; б) зросте у 8 разів; в) не зміниться; г) зменшиться вдвічі.
1.8.5. З підвищенням тиску концентрація газуватих речовин у реакційній суміші: а).не змінюється; б)збільшується; в)зменшується; г)тиск не впливає на концентрацію газів.
1.8.6. Чи зміниться стан хімічної рівноваги в наведеному рівнянні при зниженні температури: СОСІ2 ↔СО+СІ2 –Q? а) не зміниться; б)зміститься вправо; в)зміститься вліво; г) зміститься в сторону утворення хлору.
1.8.7. Чи відбудуться зміни швидкості рівноважного процесу: 2SO2 (г)+О2(г) ↔ 2SO3 (г); ∆Н=-198 кДж/моль, якщо підвищити тиск у системі? а) не відбудуться; б) прискориться прямий процес; в) прискориться зворотній процес; . г) спочатку зменшиться швидкість прямого процесу, а потім збільшиться.
1.8.8. .Як зміниться швидкість прямої реакції 2SO2+O2↔2SO3, якщо збільшити концентрацію SO2 в 4 рази? а) не зміниться; б) збільшиться у 8 разів; в) збільшиться у 4 рази г) збільшиться у 16 разів.
1.8.9. Яке співвідношення є константою рівноваги для хімічної рівноваги, описаної рівнянням реакції 2NO+O2↔2NO2 ? а)
1.8.10.Чи зміниться стан хімічної рівноваги в наведеному рівнянні при збільшенні концентрації водню: H2+S ↔H2S? а) не зміниться; б) зміститься вправо; в) зміститься вліво; г) зміститься в сторону розкладу H2S.
1.8.11. Як зміниться стан хімічної рівноваги в наведеному рівнянні при підвищенні температури 2NO+O2↔ 2NO2, ∆Н=-78кДж| моль? а) не зміниться; б)спочатку зменшиться швидкість прямого процесу, а потім збільшиться; в)зміститься вправо; г)зміститься вліво; д) спочатку збільшиться швидкість прямого процесу, а потім зменшиться.
1.8.12. Як зміниться швидкість прямої реакції: 2SO2+O2↔2SO3, якщо збільшити концентрацію SO2 в 2 рази ? а) збільшиться в 4 рази б) не зміниться в) збільшиться у 8 разів г) збільшиться у 2 рази д) збільшиться у 16 разів.
1.8.13.Закон діючих мас виражається формулою: а) в) 1.8.14. Чи зміниться стан хімічної рівноваги в наведеному рівнянні при збільшенні концентрації хлору: Н2 + Cl2 ↔ 2HCl? а) не зміниться; б) зміситься вправо; в) зміститься вліво; г) спочатку збільшиться швидкість прямого процесу, а потім зменшиться.
1.8.15. Як зміниться стан хімічної рівноваги при підвищенні температури такого процесу: 2NO+O2 ↔2NO2, ∆Н=-78кДж/моль? а) прискориться прямий процес; б) не зміниться; в) прискориться зворотній процес; г) спочатку зменшиться швидкість зворотного процесу, а потім збільшиться.
1.8.16. Чи відбудуться зміни швидкості рівноважного процесу: 2НІ(г) ↔ Н2(г) + І2(г), ∆Н = -198 кДж/моль, якщо збільшити об’єм системи у два рази? а) не відбудуться; б) прискориться прямий процес; в) прискориться зворотний процес; г) спочатку зменшиться
1.8.17.Стан хімічної рівноваги констатує: а) ν прямої > ν зворотної; б) ν зворотної > ν прямої; в) ν прямої = ν зворотної.
1.8.18 Чи зміниться стан хімічної рівноваги в наведеному рівнянні при підвищенні тиску: Н2 + І2↔2НІ? а) не зміниться; б) зміститься вправо; в) зміститься вліво.
1.8.19. Яке з наведених нижче тверджень є вірним: а) каталізатори не беруть участі в реакції; б) каталізатори беруть участі в реакції, знижуючи енергію активації; в) каталізатор входить до складу продуктів реакції; г) каталізатор не входить до складу продуктів реакції.
1.8.20. Чи зміниться стан хімічної рівноваги у наведеному рівнянні при зниженні температури: COCl2 ↔ CO + Cl2 – Q? а) не зміниться; б) зміститься вправо; в) зміститься вліво; г) спочатку збільшиться швидкість прямого процесу, а потім зменшиться.
1.8.21. З підвищенням тиску концентрація газуватих речовин у реакційній суміші: а).не змінюється; б)збільшується; в)зменшується; г)тиск не впливає на концентрацію газів.
1.8.22. .Який вираз константи рівноваги відповідає системі: Fe3O4(т) + 4H2(г) ↔ 3Fe(т) + 4H2O(г) а) в)
1.8.23. Чи зміниться стан хімічної рівноваги в наведеному рівнянні при зменшенні концентрації кисню: 3O2 ↔ 2O3 + Q? а) не зміниться; б) зміститься вправо; в) зміститься вліво; г) спочатку збільшиться швидкість прямого процесу, а потім зменшиться.
1.8.24. Чому з підвищенням температури відбувається різке збільшенням швидкості реакції? а) тому, що збільшується швидкість руху молекул; б) тому, що збільшується концентрація молекул; в) тому, що збільшується число зіткнень активних молекул; г) тому, що збільшується тиск у системі.
ІІ рівень 2.8.1. У скільки разів збільшиться швидкість хімічної реакції при нагріванні від 298К до 338К, якщо температурний коефіцієнт реакції дорівнює 2. 2.8.2. Визначити середню швидкість хімічної реакції, якщо концентрація однієї з реагуючих речовин через 15сек. після початку реакції дорівнювала 0,05моль/л, а через 25сек. стала 0,001 моль/л. 2.8.3. Кінетичне рівняння реакції ν = k [А]2 [В]. У скільки разів зменшиться швидкість хімічної реакції при зменшенні концентрації реагуючих речовин у два рази? 2.8.4. Елементарна реакція протікає за рівнянням А + 2В=С. Вихідні концентрації речовин А і В рівні 0,04 моль/л. Через деякий час концентрація речовини В зменшилась на 0,02 моль/л. Як зміниться за цей же час концентрація речовини А? 2.8.5. Обчислити у скільки разів збільшиться швидкість реакції, якщо підвищити температуру на 40К. Температурний коефіцієнт дорівнює З? 2.8.6. Розрахувати швидкість реакції Н2(г) + 12(г)=2НІ(г), якщо початкова концентрація водню дорівнює 0,5 моль/л, концентрація йоду 0,2 моль/л. Константа швидкості дорівнює 0,18 л/моль·с. 2.8.7. Розрахувати швидкість елементарної реакції А + В =С + D, якщо початкова концентрація речовини А дорівнює 0,03 моль/л, а речовини В 0,02 моль/л. Константа швидкості дорівнює 0,16 л/моль·с. 2.8.8. У системі 2SO2(г) + О2(г) ↔ 2SO3(р), ∆Н°<0; встановилася рівновага. Зміною яких параметрів можна досягти зміщення рівноваги у бік утворення SO2? 2.8.9. Рівновага реакції розкладу NO2 за реакцією 2NO2↔ 2NO+O2 встановилася при концентраціях (моль/л): [NO2] = 0,02; [NO] = 0,08; [O2] =0,16. Обчисліть константу рівноваги цієї реакції, відповідь підтвердіть розрахунком. а) 1,28 б) 0,64 в) 2,56 г)1,92. 2.8.10. У скільки разів зросте швидкість реакції 2СО+О2=2СО2, якщо температура збільшилася з 900 до 120оС (γ=3)? Наведіть розрахунок. а) у 12 разів; б) у 27 разів; в) у 81 раз; г) у 9 разів. 2.8.11. У скільки разів збільшиться швидкість реакції з температурним коефіцієнтом (γ=3), якщо температура підвищиться на 30оС?: а) у 3 рази; б) у 9 разів; в) у 6 рази; г) у 27 разів; д) у 81 разів. 2.8.12. Обчислити початкові концентрації хлору і карбон (ІІ) оксиду реакції СО+СІ2 ↔СОСІ2,якщо рівноважні концентрації (моль/дм.3): [СІ2] =0,3; [СО] =0,2; [СОСІ2]=1,5. а) 1,5СО і 1,5 СІ2; б) 1,7СО і 1,8 СІ2; в) 1,3СО і 1,7СІ2; г)1,8 СО і 1,7 СІ2. 2.8.13. В скільки разів збільшиться швидкість реакції N2O4 ↔ 2NO2, якщо температура зросла на 400С (γ=3)? а) у 12 разів; б) у 9 разів; в) у 27 разів; г) у 81 раз; д) у 243 рази. 2.8.14. Обчислити початкові концентрації хлору і карбон (ІІ) оксиду реакції СО+СІ2 ↔СОСІ2, якщо рівноважні концентрації (моль/дм.3): [СІ2] =0,3; [СО] =0,2; [СОСІ2]=1,5. а) 1,5СО і 1,5 СІ2; б) 1,7СО і 1,8 СІ2; в) 1,3СО і 1,7СІ2; г)1,8 СО і 1,7 СІ2. 2.8.15. Як зміниться швидкість реакції: 2NO + Cl2 ↔ 2NOCl, якщо збільшити температуру від 1300С до 1800С. Температурний коефіцієнт рівний трьом (γ=3): а) зросте у 243 рази; б) зросте у 6 разів; в) зросте у 9 разів; г) зросте у 27 разів; д) зросте у 81 раз. 2.8.16. Рівноважні концентрації в реакції СО(г) + Cl2(г) ↔ СOCl2(г) дорівнюють [Сl2] = 0,6моль/дм3; [СО] = 0,3 моль/дм3; [СОCl2] = 3,6 моль/дм3. Визначіть константу рівноваги: а) 6; б) 10; в) 12 г) 20; д) 36. 2.8.17.В скільки разів збільшиться швидкість процесу 2А + В ↔ С, якщо збільшити температуру від 200 до 700 С(γ=3)? а) у 60 разів; б) у 210 разів; в) у 243 рази; г) у 729 разів; д) у 2187 разів. 2.8.18. На скільки градусів слід підвищити температуру , щоб швидкість реакції зросла у 8 разів (γ =2); а) на 40o С; б) на 80o C; в) на 30о С; г) на 20оС; д) на 160оС. 2.8.19. Рівноважні концентрації в реакції СО2(г) + Cl2(г) ↔ СOCl2(г) дорівнюють [Сl2] = 0,3моль/дм3; [СО] = 0,2 моль/дм3; [СОCl2] = 1,2 моль/дм3. Визначіть константу рівноваги: а) 6; б) 10; в) 12 г) 20; д) 36.
КОМПЛЕКСНІ СПОЛУКИ
1.15.1. Для комплексної сполуки [Ag(NH3)2]OH йон Ag+ є: а) комплексоутворювачем; б) лігандом; в) зовнішньою сферою; г) внутрішньою сферою. 1.15.2. Для комплексної сполуки [Ag(NH3)2]OH група частинка NH3+ є: а) комплексоутворювачем; б) лігандом; в) зовнішньою сферою; г) внутрішньою сферою.
1.15.3. Для комплексної сполуки [Ag(NH3)2]OH група OH- є: а) комплексоутворювачем; б) лігандом; в) зовнішньою сферою; г) внутрішньою сферою.
1.15.4. Для комплексної сполуки [Ag(NH3)2]OH йон [Ag(NH3)2]+ є: а) комплексоутворювачем; б) лігандом; в) зовнішньою сферою; г) внутрішньою сферою.
1.15.5. Для комплексної сполуки Fe4[Fe(CN)6]3 йон Fe+3 є: а) комплексоутворювачем; б) лігандом; в) зовнішньою сферою; г) внутрішньою сферою.
1.15.6. Для комплексної сполуки Fe4[Fe(CN)6]3 йон Fe+2 є: а) комплексоутворювачем; б) лігандом; в) зовнішньою сферою; г) внутрішньою сферою. 1.15.7. Для комплексної сполуки Fe4[Fe(CN)6]3 група CN- є: а) комплексоутворювачем; б) лігандом; в) зовнішньою сферою; г) внутрішньою сферою. 1.15.8. Для комплексної сполуки Fe4[Fe(CN)6]3 йон [Fe(CN)64-] є: а) комплексоутворювачем; б) лігандом; в) зовнішньою сферою; г) внутрішньою сферою. 1.15.9. Для комплексної сполуки [Cu(NH3)4](OH)2 йон Cu2+ є: а) комплексоутворювачем; б) лігандом; в) зовнішньою сферою; г) внутрішньою сферою.
1.15.10. Для комплексної сполуки [Cu(NH3)4](OH)2 молекула NH3 є: а) комплексоутворювачем; б) лігандом; в) зовнішньою сферою; г) внутрішньою сферою.
1.15.11. Комплексоутворювач повинен бути: а) акцептором електронів, мати вільні електронні орбіталі; б) нейтральною частинкою; в) оксигеновмісним, г) донором електронних пар.
1.15.12. Лігандповинен бути: а) акцептором електронів, мати вільні електронні орбіталі; б) нейтральною частинкою; в) оксигеновмісним, г) донором електронних пар. 1.15.13. Характерним типом зв’язку між комплексоутворювачем і лігандами є зв’язок: а) ковалентний; б) йонний; в) донорно-акцепторний г) водневий.
1.15.14. В якій із комплексних сполук комплексоутворювачем є Fe2+: а) K4[Fe(CN)6]; б) K3[Fe(CN)6]; в) Fe(OH)2Cl г) Fe2(SO4)3
1.15.15. В якій із комплексних сполук комплексоутворювачем є Fe3+: а) K4[Fe(CN)6]; б) K3[Fe(CN)6]; в) Fe(OH)2Cl г) Fe2(SO4)3
1.15.16. Який з перелічених катіонів можуть бути комплексоутворювачем? а) K+; б) Na+ в) Co2+ г) NH4+
1.15.17. Яка з частинок може стати комплексоутворювачем? а) OH-; б) Cu2+; в) СN-; г) Н2О;
1.15.18. Яка з частинок може стати комплексоутворювачем? а) Fe2+; б) Cl-; в) OH-; г) Br-;
1.15.19. Яка з частинок може стати комплексоутворювачем? а) Co3+; б) OH-; в) СN-; г) SCN;
1.15.20. Яка з частинок може стати комплексоутворювачем? а) Al3+; б) H2O; в) SО42-; г) OH-;
1.15.21.. Яка з частинок може стати лігандом? а) Cu2+; б) Cu+; в) Ag+; г) OH-;
1.15.22. Яка з частинок може стати лігандом: а) Fe2+; б) Cl-; в) Fe3+; г) Zn2+; 1.15.23.Яка з частинок може стати лігандом: а) NН3; б) Mg2+; в) Cu2+; г) Cr3+; 1.15.24. Яка з частинок може стати лігандом: а) H2O; б) Zn2+; в) Al3+; г) Sn2+;
1.15.25. В якій із наведених сполук H2O є лігандом: а)CuSO4*5H2O; б) K[Al(OH)4(H2O)2]; в) [Zn(NH3)2](OH)2 г)FeSO4•7H2O;
1.15.26. В якій із наведених сполук ціанід-йон є лігандом: а) Zn(СN)2; б) K2[PtCl4]; в)K2[Au(CN)4]; г) Fe(CN)3 1.15.27. В якій із наведених сполук хлорид-йон є тільки лігандом: а) ZnCl2; б) K2[PtCl4]; в) [Ag(NH3)2]Cl; г) [PtCl2]Cl2;
1.15.28. Яка із перелічених частинок може грати роль ацидного ліганда: а) Cl-; б) NH3; в) СО; г) NH4+;
1.15.29. Яка із перелічених частинок може грати роль нейтрального ліганда: а) Cl-; б) NH3; в) СN; г) OH-;
1.15.30. Яка із перелічених частинок може грати роль акваліганда: а) Cl-; б) NH3; в) СО; г) Н2О;
1.15.31. При дії надлишку розчину гідроксиду амонію на катіон Cu2+ утворюються: а) гідроксиди цих металів; б) основні солі цих металів; в) аквакомплекси; г) аміакaтні комплекси цих сполук.
1.15.32. При дії надлишку розчину гідроксиду амонію на катіон Cо2+ утворюються: а) гідроксиди цих металів; б) основні солі цих металів; в) аквакомплекси; г) аміакaтні комплекси цих сполук.
1.15.33. При дії надлишку розчину гідроксиду амонію на катіон Zn2+ утворюються: а) гідроксиди цих металів; б) основні солі цих металів; в) аквакомплекси; г) аміакaтні комплекси цих сполук.
1.15.34. Ціанкобаламін (вітамін В12) є комплексною сполукою кобальту. До якого типу комплексних сполук він належить? а) катіонних комплексів; б) аквакомплексів; в) ціанідних комплексів; г) хелатних комплексів.
1.15.35. Хлорофіл є комплексною сполукою магнію. До якого типу комплексних сполук він належить? а) катіонних комплексів; б) аквакомплексів; в) ціанідних комплексів; г) хелатних комплексів.
1.15.36. Гемоглобін є комплексною сполукою заліза. До якого типу комплексних сполук він належить? а) катіонних комплексів; б) аквакомплексів; в) ціанідних комплексів; г) хелатних комплексів.
1.15.37. Амінокислоти можуть утворювати комплекси з йонами кобальту. До якого типу комплексних сполук він належить? а) катіонних комплексів; б) аквакомплексів; в) ціанідних комплексів; г) хелатних комплексів.
1.15.38. Комплексна сполука, що сприяє участі рослин у фотосинтезі називається: а) гемоглобін; б) ціанкобаламін; в) трилон Б; г)хлорофіл.
1.15.39. Які із наведених речовин грають роль комплексону в хелатотерапії? а)трилон Б; б) амінооцтова кислота ; в)сода г)аміак.
ГІДРОЛІЗ СОЛЕЙ 1.9.1. Гідроліз солі – це реакція взаємодії солі з водою, в результаті якої: а) порушується рівновага дисоціації води, утворюється слабкий електроліт і, як правило, змінюється кислотність середовища; б) утворюються сильні електроліти, змінюється кислотність середовища; в) кислотність середовища не змінюється, утворюються сильні електроліти; г) не порушується рівновага дисоціації води; д) утворюється газ або осад, не змінюється кислотність середовища.
1.9.2. Посилення гідролізу солей при підвищенні температури пояснюється: а) збільшенням швидкості ендотермічної реакції дисоціації води; б) зменшенням швидкості ендотермічної реакції дисоціації води; в) зменшенням швидкості екзотермічної реакції дисоціації води; г) додавання СН3СООН; д) збільшенням швидкості екзотермічної реакції дисоціації води.
1.9.3. Константа гідролізу (Кr) солі слабкої кислоти і сильної основи або слабкої основи і сильної кислоти – це відношення іонного добутку води (Кв) до: а) константи дисоціації слабкого електроліту; б) суми молярних концентрацій іонів гідрогену та гідроксиду; в) добутку молярних концентрацій іонів гідрогену та гідроксиду; г) кількості речовин солі, що прогідролізувала; д) кількості речовин солі, що продесоціювала.
1.9.4. Ступінь гідролізу солі (αr) – це відношення до загальної кількості речовини розчиненої солі: а) молярної концентрації солі; б) масової концентрації солі; в) масової частки солі; г) кількості речовин солі, що прогідролізувала; д) кількості речовин солі, що продесоціювала. 1.9.5. Ступінь гідролізу солі (αr) зростає при: а) збільшенні концентрації солі; б) зниженні температури; в) зниженні температури та збільшенні концентрації солі; г)зменшенні концентрації солі; д) додаванні солі, утвореної сильною кислотою та лугом.
1.9.6. Вказати, яка дія змістить рівновагу гідролізу натрій ацетату вліво: а) підвищення температури; б) додавання натрій ацетату; в) додавання води; г) додавання СН3СООН; д) додаванні солі, утвореної сильною кислотою та лугом.
1.9.7. Гідролізу не підлягають солі, утворені: а) слабкою кислотою та сильною основою (лугом); б) слабкою основою та сильною кислотою; в) сильною кислотою та сильною основою (лугом); г) слабкою кислотою та слабкою основою; д) кислим залишком та катіоном металу.
1.9.8. Назвати водний розчин електроліту, що має найменше значення рН: а) NaCl; б) KCl; в) CaCl2; г) NH4Cl; д) BaCl2. 1.9.9. Із наведених нижче солей виберіть ту, що зазнає гідролізу: а) ферум (ІІІ) нітрат; б) барій хлорид; в) аргентум бромід; г) калій нітрат; д) натрій сульфат.
1.9.10. Із наведених нижче солей виберіть ту, що зазнає гідролізу: а) ферум (ІІ) хлорид; б) барій хлорид; в) аргентум хлорид; г) калій хлорид; д) натрій хлорид. 1.9.11. Із наведених нижче солей виберіть ту, водний розчин якої слабкокислий: а) хром (ІІІ) сульфат; б) барій хлорат; в) натрій карбонат; г) натрій хлорат; д) калій перхлорат. 1.9.12. Із наведених нижче солей виберіть ту, водний розчин якої слабколужний: а) калій нітрат; б) калій сульфат; в) калій хлорат; г) калій сульфід; д) калій бромід.
1.9.13. Із наведених нижче солей виберіть ту, водний розчин якої слабколужний: а) калій сульфат; б) калій сульфіт; в) аргентум нітрат; г) барій сульфат; д) натрій хлорид.
1.9.14. Із наведених нижче солей виберіть ту, водний розчин якої лужний: а) натрій сульфат; б) натрій ціанід; в) аргентум нітрат; г) натрій нітрат; д) натрій бромід.
1.9.15. Яка із наведених солей не гідролізує: а) AlPO4; б) AlCl3; в) Al2(SO4)3; г) Al(NO3)3; д) Al2S3.
1.9.16. Яка із наведених солей не гідролізує: а) AlPO4; б) NaCl; в) AgNO3; г) Cu(NO3)2; д) K2S.
1.9.17. Яка реакція середовища сечі, якщо аналізи показали, що в ній містяться такі солі: NH4Cl, NH4Н2PO4, (NH4)2SO4: а) кисла; б) лужна; в) нейтральна; г) слабколужна; д) слабкокисла. 1.9.18. Реакція середовища при гідролізі солі, утвореної слабкою кислотою та сильною основою (лугом), буде: а) нейтральна; б) слабкокисла; в) кисла; г) лужна; д) слабколужна.
1.9.19. Яке значення рН матиме розчин при гідролізі солі, утвореної слабкою кислотою та лугом: а) рН<7; б) рН≈7; в) рН=7; г) рН>7; д) рН=0.
1.9.20. Яке значення рН матиме розчин при гідролізі солі, утвореної слабкою основою та сильною кислотою: а) рН<7; б) рН≈7; в) рН=7; г) рН>7; д) рН=0.
1.9.21. Яке значення рН матиме розчин при гідролізі солі, утвореної слабкою кислотою та слабкою основою, якщо Кд(основи)= Кд(кислоти): а) рН<7; б) рН≈7; в) рН=7; г) рН>7; д) рН=0.
1.9.22. Із наведених нижче солей виберіть ту, водний розчин якої кислий: а) натрій сульфат; б) натрій ціанід; в) аргентум нітрат; г) калій нітрат. ІІ рівень 2.9.1. Написати іонне та молекулярне рівняння першої стадії гідролізу натрій карбонату. 2.9.2. Написати іонне та молекулярне рівняння першої стадії гідролізу натрій фосфату. 2.9.3. Написати іонне та молекулярне рівняння першої стадії гідролізу ферум (ІІІ) хлориду. 2.9.4. Написати іонне та молекулярне рівняння першої стадії гідролізу амоній ацетату. 2.9.5. Написати іонне та молекулярне рівняння першої стадії гідролізу алюміній ацетату. 2.9.6. Добуток розчинності СаSO4 9-10-6 моль2/л2. Визначити масову концентрацію сульфату кальцію ρ(СаSO4) в насиченому розчині. М(СаSO4) = 136г/моль. 2.9.7. Кісткова тканина починає формуватися в плазмі крові, чи достатньою є концентрація катіону кальцію у вільному стані с(Са2+)=1,0 10-3 моль/л для утворення осаду СаНРO4; щодо концентрації гідрофосфат-іонів, то вона, становить в плазмі крові с(НРO42- )=2,9-10-4 моль/л, ДР (СаНРO4) = 2,7 10-7 моль2/л2 ? 2.9.8. Чи випаде осад при змішуванні рівних об'ємів розчинів ВаС12 та Na2SO4, молярна концентрація яких 0,04моль/л? ДРBa2SO4= 1,1 · 10-10 моль2/л2 . 2.9.9. Кісткова тканина починає формуватися в плазмі крові, чи достатньою є масова концентрація ρ(СаHРO4) = 1,36·10-6 г/л, для утворення в плазмі крові осаду СаНРO4; М(СаНРO4) = 136,05 г/моль, ДР (СаНРO4) = 2,7-10-7 моль2/л2? 2.9.10. Добуток розчинності ВаSO4 = 1-10-10 моль2/л2. Визначити масову концентрацію барій сульфату ρ(ВаSO4) в насиченому розчині. М(ВаSO4) = 233 г/моль.
ЕЛЕКТРОХІМІЧНІ ПРОЦЕСИ
1.10.1. При переході йону міді з поверхні в розчин на поверхні металу виникає заряд: а) позитивний; б) негативний; в) не виникає заряду; г) виділяється газ.
1.10.2. При переході йону цинку з поверхні в розчин на поверхні металу виникає заряд: а) позитивний; б) негативний; в) не виникає заряду; г) виділяється газ.
1.10.3. Подвійний електричний шар на межі метал-розчин зумовлює виникнення: а) електродного потенціалу; б) потенціалу іонізації; в) водневого потенціалу; г) адсорбційного потенціалу.
1.10.4. Найбільший вплив на значення електродного потенціалу має: а) природа металу; б) концентрація; в) температура; г) тиск.
1.10.5. Рівняння Нернста виражає виражає залежність електродного потенціалу від: а) концентрації; б) тиску; в) розчинника; г) часу.
1.10.6. Рівняння Нернста виражає виражає залежність електродного потенціалу від: а) температури; б) тиску; в) розчинника; г) часу.
1.10.7. Стандартний електродний потенціал показує залежність електродного потенціалу в стандартних умовах від: а) природи металу; б) концентрації; в) тиску; г)температури.
1.10.8. Залежність значення електродного потенціалу від різних факторів виражається рівнянням: а) Нернста; б) Гібса; в) Вант-Гоффа; г) Гесса.
1.10.9. В рівнянні Нернста величина n показує: а) кількість електронів, що передаються від відновника до окисника; б) кількість молів окисника; в) кількість молів відновника; г) відношення концентрації окисника до відновника.
1.10.10. Для вимірювання електродного потенціалу необхідно в досліджуваний розчин занурити електроди: а) вимірювання і порівняння; б) водневий і каломельний; в) скляний і мембранний; г) хлорсрібний і водневий.
1.10.11. До електродів вимірювання належать: а) скляний і мембранний; б) хлорсрібний і водневий; в) водневий і скляний; г) каломельний і скляний.
1.10.12. До електродів порівняння належать: а) хлорсрібний і водневий; б) водневий і скляний; в) скляний і хлорсрібний; г) каломельний і скляний.
1.10.13. Окисником буде речовина у якої значення стандартного потенціалу буде: а) більше; б) менше; в) однакове; г) від’ємне.
1.10.14. Відновником буде речовина у якої значення стандартного потенціалу буде: а) більше; б) менше; в) однакове; г) додатнє.
1.10.15. Окисно-відновний потенціал не залежить від: а) температури; б) тиску; в) концентрації; г) рН-розчину.
1.10.16. Рівняння Нернста-Петерса відрізняється від рівняння Нернста залежністю від: а) відношення окисленої форми до відновленої; б) відношення відновленої форми до окисленої; в) температури; г) тиску.
1.10.17. Стандартний потенціал водневого електроду рівний: а) нулю; б) +0,202 В; в) -0,202; г) +0,42.
1.10.18. Стандартний потенціал хлорсрібного електроду рівний: а) нулю; б) +0,202 В; в) -0,202; г) +0,42.
1.10.19. До електродів І роду відноситься електрод: а) хлорсрібний; б) метал-йон металу: в) водневий; г) каломельний.
1.10.20. До електродів ІІ роду відноситься електрод: а) хлорсрібний; б) каломельний: в) водневий; г) метал-метал.
1.10.21.До вимірювання рН розчину за допомогою потенціометра необхідно використати пару електродів: а) скляний і хлорсрібний; б) водневий і йонселективний; в) каломельний і хлорсрібний; г) каломельний і водневий.
1.10.22.Зміна ступеня окиснення Fe у гемі цитохрому відбувається за розрахунком: а) дегідрогенізації водню; б) окиснення киснем; в) передачею електрону; г) передачею атому.
1.10.23.При якому значенні енергії Гіббса ∆G = -nFE: а) ∆G < 0; б) ∆G > 0; в) ∆G = 0; г)не залежить.
1.10.24.Значення стандартного біопотенціалу: а) -0,42В; б) -0,202В; в) 0; г) +0,202В.
1.10.25.Здатність окисно-відновної пари бути окисниками виражається при значеннях потенціалу: а) позитивному; б) негативному; в) рівному нулю; г) не має значення.
1.10.26. Потенціал, що утворюється на межі розчин-розчин за рахунок різної швидкості руху аніону і катіону називається: а) дифузійним; б) мембранним; в) потенціалом спокою; г) потенціал дії.
1.10.27.Потенціал, що виникає на межі прониклої перегородки називається: а) дифузійним; б) мембранним; в) потенціалом спокою; г) потенціал дії.
1.10.28.Раптове підвищення чи зниження мембранного потенціалу називають: а) дифузійним; б) мембранним; в) потенціалом спокою; г) потенціал дії.
1.10.29.В основі вимірювання електрокардіограми покладено реєстрація між електродами: а) різниці потенціалів; б) тиску; в) електричного струму; г) температури.
1.10.30.Потенціал спокою – це: а) різниця між потенціалом зовнішньої і внутрішньої сторони клітинної мембрани у стані фізіологічного спокою клітини; б) різниця між потенціалом внутрішньої і зовнішньої сторони ядерної мембрани клітини у стані спокою; в) потенціал, що виникає на внутрішній стороні мембрани у стані фізіологічного спокою клітини; г) сума потенціалів зовнішньої і внутрішньої сторони клітинної мембрани у стані фізіологічного спокою клітини.
1.10.31. Йонселективним мембранним електродом можна виміряти концентрацію: а) певного йону; б) будь-якого йону в) всіх катіонів; г) всіх аніонів.
1.10.32. Принцип дії мембранного електроду базується на визначенні потенціалу системи за рахунок різниці: а) тиску; б) концентрації; в) температури; г) співвідношення.
1.10.33. Методом потенціометричного титрування можна визначити: а) тиск; б) температури; в) концентрації; г) потенціал іонізації.
1.10.34. При вимірюванні рН шлункового соку встановлено його значення 1,65. У цього пацієнта: а) підвищена кислотність; б) понижена кислоність; в) нормальна кислотність; г) підвищена основність.
1.10.35. При вимірюванні рН шлункового соку встановлено його значення 0,85. У цього пацієнта: а) підвищена кислотність; б) понижена кислоність; в) нормальна кислотність; г) підвищена основність.
1.10.36. При вимірюванні рН шлункового соку встановлено його значення 2,5. У цього пацієнта: а) підвищена кислотність; б) понижена кислотність; в) нормальна кислотність; г) підвищена основність.
1.10.37. При вимірюванні рН плазми крові встановлено його значення 7,36. У цього пацієнта: а) ацидоз; б) алкалоз; в) рН в нормі; г) рН вище норми.
1.10.38. При вимірюванні рН плазми крові встановлено його значення 7,29. У цього пацієнта: а) ацидоз; б) алкалоз; в) рН в нормі; г) рН вище норми.
1.10.39. При вимірюванні рН плазми крові встановлено його значення 7,50. У цього пацієнта: а) ацидоз; б) алкалоз; в) рН в нормі; г) рН нижче норми.
1.10.40. Потенціал дії – раптове підвищення та падіння мембранного потенціалу в межах: а) від -75 до +50 МВ; б) від -50 до +75 МВ; в) від +50 до -75 МВ; г) від +75 до -50МВ.
1.10.41. Від’ємне значення потенціалу напівреакції 2Н3О+ + 2е ↔ Н2 + 2Н2О свідчить про: а) відновні властивості; б) окисні властивості; в) кислотно-основні властивості; г) здатність приймати електрони.
1.10.42. Додат |



 д)
д) 
 б)
б)  в)
в) 
 б)
б) 
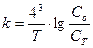 г)
г) 

 б)
б) 
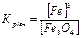 г)
г) 