 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Г) від константи дисоціації і не залежить від тиску.
1.4.4. Для розрахунку рН буферного розчину необхідно знати: а) константу дисоціації і співвідношення кислота: сіль: б) тиск і температуру; в) константу дисоціації і температуру; г) співвідношення співвідношення кислота : сіль і тиск розчину.
1.4.5. рН кислотного буферу залежить від: а) співвідношення компонентів; б) тиску; в) температури; г) часу.
1.4.6. рН основного буферу залежить від: а) природи речовин; б) тиску; в) температури; г) часу.
1.4.7. Серед написаних сумішей виберіть ті, що мають буферну дію: а) H2CO3; KHCO3; б) HNO3; NH4NO3; в) H2CO3; NH4Cl; г) NH4OH; NaH2PO4.
1.4.8.Серед написаних сумішей виберіть ті, що мають буферну дію: а) H2CO3; NH4Cl; б) HNO3; NH4NO3; в) Na2HPO4; H3PO4; г)CH3COOH; CH3COONa.
1.4.9. Кислотним буфером є суміш: а) СН3СООН і СН3СООNa б) NH4Cl і NH4OH; в) Na2HPO4 і NaH2PO4; г) Na2CO3 і NaHCO3.
1.4.10. Основним буфером є суміш: а) СН3СООН і СН3СООNa б) NH4Cl і NH4OH; в) Na2HPO4 і NaH2PO4; г) Na2CO3 і NaHCO3.
1.4.11. Ацетатна буферна система представлена рівнянням: а) СН3СООН + СН3СООNa б) CH3COOH + NaSO4 в) CH3COOH + NaOH г) HCl + CH3COONa
1.4.12. Гідрокарбонатна буферна система представлена рівнянням: а) H2CO3 + NaCl; б) H2CO3 + Na2CO3; в) H2CO3 + NaHCO3; г) HCl + NaOH.
1.4.13. Ацетатний буферний розчин в залежності від співвідношення кислоти і солі може існувати в діапазоні рН: а) 3,7 – 5,6; б) 6,2 – 8,2; в) 1,3 – 3,4; г) 5,8 – 6,9.
1.4.14. Амонійний буферний розчин в залежності від співвідношення кислоти і солі може існувати в діапазоні рН: а) 8,4 – 10,3; б) 5,4 – 6,8; в) 6,8 – 8,3; г) 4,1 – 5,6.
1.4.15. Фосфатний буферний розчин в залежності від співвідношення кислоти і солі може існувати в діапазоні рН: а) 5,9 – 8,0; б) 4,8 – 7,2; в) 8,1 – 9,5; г) 3,2 – 5,8. 1.4.16. Яка із фосфатних буферних систем, що складається із 0,02 молярних розчинів Na2HPO4 i NaH2PO4 , поданих нище, має значення рН=6,81: а) 40 мл Na2HPO4 та 40 мл NaH2PO4; б) 10 мл Na2HPO4 та 20 мл NaH2PO4; в) 20 мл Na2HPO4 та 30 мл NaH2PO4; г) 25 мл Na2HPO4 та 40 мл NaH2PO4.
1.4.17. Ацетатна буферна система, яка відповідає значенню рН=4,65 складається з 0,01 молярних розчинів СН3СООН і СН3СООNa, які подані у об’ємах: а) 20 мл СН3СООН та 20 мл СН3СООNa; б) 10 мл СН3СООН та 25 мл СН3СООNa; в) 30 мл СН3СООН та 15 мл СН3СООNa; г) 20 мл СН3СООН та 10 мл СН3СООNa.
1.4.19 При якому співвідношенні кислота : сіль рН кислотної буферної системи найбільший: а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.4.20. При якому співвідношенні кислота : сіль рН кислотної буферної системи найменший: а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.4.21. При якому співвідношенні кислота : сіль рН аміачної буферної системи буде найбільша: а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.4.22. При якому співвідношенні кислота : сіль рН аміачної буферної системи буде найменша: а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.4.23. Наведіть приклади буферних розчинів утворених слабкою основою і її сіллю.
1.4.24. Наведіть приклади буферних розчинів, що містять солі багато основних слабких кислот.
1.4.25. Наведіть приклади буферних розчинів утворених солями багато основних слабких кислот.
1.4.26. Які основні протолітичні процеси відбуваються при дії на буферну систему сильної кислоти чи лугу: а) електролітична дисоціація, протоліз, нейтралізація; б) електролітична дисоціація, протоліз, гідроліз; в) гідроліз, протоліз, нейтралізація; г) окислення, гідроліз, протоліз.
1.4.27. Механізм дії буферних систем направлений на: а) відновлення кислих і лужних продуктів; б) окиснення кислих і лужних речовин; в) нейтралізацію кислих і лужних продуктів; г) гідроліз кислих і лужних продуктів. 1.4.28. Механізм дії на ацетатну буферну систему кислотою представлений в рівнянні: а) СН3СОО- + Н3О+ ↔ СН3СООН + Н2О; б) NН3∙H2O + H3O+ ↔ NH4+ + 2H2O; в) H3O+ + HCO3- ↔ H2CO3 + H2O; г) H3O+ + OH- ↔ 2H2O.
1.4.29. Механізм дії на амонійну буферну систему лугу представлений рівнянням: а) OH- + H3O+ ↔ 2H2O; б) NН3 ∙ H2O + H3O+ ↔ NH4+ + 2H2O; в) OH- + HCO3- ↔ HCO3- + H2O г) OH- + NH4+ ↔ NH3 ∙ H2O.
1.4.30. Механізм дії на гідрокарбонатну буферну системукислотою представлений в рівнянні: а) Нb- + H3O+↔HHb + H2O; б) H3O+ + OH- ↔ 2H2O; в) HPO4-2 + H3O+ ↔ H2PO4- + H2O; г) H3O+ + HCO3- ↔ H2CO3 + H2O.
1.4.31. Механізм дії на гідрокарбонатну буферну систему кислотою представлений рівнянням: а) H3O+ + HCO3- ↔ H2CO3 + H2O; б) НСО-3 + OH- ↔ H2CO3 в) H2CO3 + OH- ↔ HCO-3 + H2O г) H3O+ + OH- ↔ 2H2O.
1.4.32. Механізм дії на фосфатну буферну систему кислотою представлений: а) НРО4-2 + Н3О+ ↔ Н2РО4- + Н2О б) НРО4- + Н3О+ ↔ Н3РО4- + ОН- в) Н2РО4- + ОН- ↔ НРО4-2 + Н2О+ г) НРО4-2 + Н2О+ ↔ Н2РО4- + ОН-.
1.4.33. Напишіть механізм дії аміачної буферної системи при надходженні кислих і лужних продуктів.
1.4.34. Напишіть механізм дії на гідрокарбонтні буферні розчини кислот і лугу.
1.4.35. Напишіть механізм дії на фосфатний буферний розчин кислоти і лугу
1.4.36. Напишіть механізм дії на ацетатний буферний розчин кислоти і лугу.
1.4.37. Рівняння Гендерсона для підрахунку рН кислотних буферних систем: а) б) в) г) 1.4.38. Рівняння Гендерсона для підрахунку рН основних буферних систем: а) б) в) г) 1.4.39. Для розрахунку рН основного буферу необхідно скористатись формулою: а) б) в) г) 1.4.40. Біохімічні буферні системи організму: а) гідрокарбонатна, фосфатна, гемоглобінова, білкова; б) фосфатна, ацетатна, білкова, гідрокарбонатна; в) гемоглобінові, білкова, фосфатна, амонійна; г) білкова, ацетатна, амонійна, фосфатна.
1.4.41. У плазмі крові найбільшу роль відіграють буферні системи: а) аміачна; б) гідрокарбонатна; в) ацетатна; г) гемоглобінна.
1.4.42. У плазмі крові найбільшу роль відіграють буферні системи: а) фосфатна; б) гемоглобінова; в) аміачна; г) ацетатна.
1.4.43. У еритроцитах переважає буферна система: а) фосфатна; б) гемоглобінова; в) аміачна; г) ацетатна.
1.4.44. Які функціональні групи білкових молекул зумовлюють їх буферну дію? а) –СООН; -NO2; б) –СООН; -NН2; в) -NН2; -CN; г) -NН2; -NO2.
1.4.45.Механізм дії буферних систем направлений на: а) нейтралізацію кислих і лужних продуктів; б) відновлення кислих і лужних продуктів; в) гідроліз кислих і лужних продуктів; г) окиснення кислих і лужних речовин.
1.4.46. Які основні протолітичні процеси відбуваються при дії на буферну систему сильної кислоти: а) гідроліз, протоліз, нейтралізація; б) окислення, гідроліз, протоліз; в) електролітична дисоціація, протоліз, нейтралізація; г) електролітична дисоціація, протоліз, гідроліз.
1.4.47. Механізм дії гідрокарбонатної буферної системипри надходженні лужних продуктів представлений рівнянням: а) Н3О+ + НСО3- ↔ Н2СО3 + Н2О б) Н3О+ + ОН- ↔ 2 Н2О в) Н2СО3 + ОН- ↔ НСО3- + Н2О г) Н2СО3 + Н2О ↔ НСО3- + Н3О+
1.4.48. Механізм дії на гідрокарбонатну буферну систему кислотою представлений рівнянням: а) Н3О+ + ОН- ↔ 2Н2О б) Н2СО3 + ОН- ↔ НСО3- + Н2О в) Н3О+ + НСО3-↔ 2 Н2О г) Н2СО3 + Н2О ↔ НСО3- + Н3О+
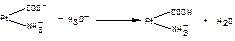
1.4.49. Механізм дії буферної системи оксигемоглобін-гемоглобін при надходженні кислих продуктів представлений рівнянням: а) ННb + OH- ↔ Hb- + H2O HHbO2 + OH- ↔ HbO2- + H2O; б) Hb- + H3O+ ↔ ННb + H2O HbO2- + H3O+ ↔ HHbO2 + H2O; в) Hb- + H2O ↔ ННb + OH- HbO2- + H2O ↔ HHbO2 + OH-; г) Hb- + Н2СО3 ↔ HHbO2 + НСО3- HbO2- + Н2СО3 ↔ HHbO2 + НСО3-.
1.4.50. Буферна система оксигемоглобін-гемоглобін характеризується рівновагою між йонами: а) Hb- і ННb б) Hb- і OH- HbO2- і HHbO2; HbO2- і OH-; в) Hb- і H3O+ г) Hb- і HHbO2 HbO2- і H3O+; HbO2- і ННb.
1.4.51. Значення рН плазми крові в нормі може знаходитись: а) 7,35-7,45; б) 6,80-7,0; в) 7,15-7,35; г) 8,01-8,35.
1.4.52. Зрушення кислотно-основного стану крові у сторону підвищення концентрації йонів водню (зниження рН) називають: а) алкалозом; б) анабіозом; в) ацидозом; г) антагонізмом.
1.4.53. Зрушення кислотно-основного стану крові у сторону зменшення концентрації йонів водню (підвищення рН) називають: а) ацидозом; б) алкалозом; в) анабіозом; г) антагонізмом.
1.4.54. Яку із наведених речовин можна використовувати для коригування кислотно-основного стану організму при ацидозі: а) NaHCO3; б) NaCl в) HCl г) аскорбінову кислоту.
1.4.55. Механізм дії білкової буферної системи при надходженні кислих продуктів представлений рівняням: а) б) в) г)
ІІ рівень 2.4.1. Обчислити рН амонійного буфера, що складається із 400мл розчину NH4Cl з с0(NH4Cl)=0,15моль/л і 200 мл розчину аміаку з с0(NH3 · Н2О)=0,1моль/л. Кд(NH3 · Н2О)=1,8·10-5 моль/л. 2.4.2.Розрахувати кількості мл розчинів СН3СООН з с0(СН3СООН)=0,1 моль/л і СН3СООNa з с0(СН3СООNa)=0,1 моль/л, а також води, які необхідно змішати, щоб приготувати 400 мл ацетатного буфера з с(буфера)=0,05 моль/л і рН=5,24. Кд(СН3СООН)=1,75·10-5моль/л. У відповіді об’єми компонентів буфера виразити в літрах. 2.4.3. Обчислити рН ацетатного буфера, що складається із 50мл розчину СН3СООNa з с0(СН3СООNa)=0,1моль/л і 200 мл розчину СН3СООН з с0(СН3СООН)=0,05моль/л. Кд(СН3СООН)=1,75·10-5моль/л. 2.4.4. Розрахувати кількості мл розчинів Na2HPO4 з с0(Na2HPO4)=0,02 моль/л і NaH2PO4 з с0(NaH2PO4)=0,1 моль/л, а також води, які необхідно змішати, щоб приготувати 600 мл фосфатного буфера з с(буфера)=0,05 моль/л і рН=5,46. Кд(Н2РО4-)=6,2·10-8моль/л. У відповіді об’єми складових буфера виразити в літрах. 2.4.5. Обчислити рН фосфатного буфера, що складається із 150мл розчину NaH2PO4 з с0(NaH2PO4)=0,1моль/л і 200 мл розчину Na2HPO4 з с0(Na2HPO4)=0,05моль/л. Кд(Н2РО4-)=6,2·10-8моль/л. 2.4.4. Розрахувати кількості мл розчинів Na2HPO4 з с0(Na2HPO4)=0,1 моль/л і NaH2PO4 з с0(NaH2PO4)=0,1 моль/л, а також води, які необхідно змішати, щоб приготувати 600 мл фосфатного буфера з с(буфера)=0,05 моль/л і рН=5,46. Кд(Н2РО4-)=6,2·10-8моль/л. У відповіді об’єми складових буфера виразити в літрах. 2.4.6. Розрахувати кількості мл розчинів СН3СООН з с0(СН3СООН)=0,1 моль/л і СН3СООNa з с0(СН3СООNa)=0,1 моль/л, а також води, які необхідно змішати, щоб приготувати 300 мл ацетатного буфера з с(буфера)=0,1 моль/л і рН=5,46. Кд(СН3СООН)=1,75·10-5моль/л. У відповіді об’єми компонентів буфера виразити в літрах. 2.4.7. Аміачна буферна система складається з 50 мл розчину гідроксиду амонію з молярною концентрацією еквівалентів 0,2 моль/л і 200 мл хлориду амонію з молярною концентрацією еквівалентів 0,1 моль/л (Кд (NH4OH) = 179*10-5) Визначити рН даної системи. 2.4.8. Як зміниться рН даного аміачного буферу при доливанні до нього 20 мл розчину кислоти з молярною концентрацією еквівалентів 0,1 моль/л. 2.4.9. Аміачна буферна система складається з 100 мл розчину гідроксиду амонію з молярною концентрацією еквівалентів 0,1 моль/л і 50 мл хлориду амонію з молярною концентрацією еквівалентів 0,2 моль/л (Кд (NH4OH) = 179*10-5) Визначити рН даної системи. 2.4.10. Як зміниться рН даного аміачного буферу при доливанні до нього 10 мл розчину кислоти з молярною концентрацією еквівалентів 0,2 моль/л. 2.4.11. Ацетатна буферна система складається з 20 мл розчину оцтової кислоти з молярною концентрацією еквівалентів 0,1 моль/л і 50 мл ацетату натрію з молярною концентрацією еквівалентів 0,2 моль/л (Кд = 1,76*10-5) Визначити рН даної системи. 2.4.12. Як зміниться рН даного ацетатного буферу при доливанні до нього 50 мл розчину кислоти з молярною концентрацією еквівалентів 0,1 моль/л. 2.4.13. Ацетатна буферна система складається з 200 мл розчину оцтової кислоти з молярною концентрацією еквівалентів 0,1 моль/л і 100 мл ацетату натрію з молярною концентрацією еквівалентів 0,1 моль/л (КСН3СООН = 1,76*10-5) Визначити рН даної системи. 2.4.14. Як зміниться рН даного ацетатного буферу при доливанні до нього 20 мл розчину кислоти з молярною концентрацією еквівалентів 0,1 моль/л. 2.4.15. Як зміниться рН фосфатного буферу, який складається з 200 мл розчину гідро фосфату калію з молярною концентрацією еквівалентів 0,1 моль/л і 100 мл дигідрофосфату калію з молярною концентрацією еквівалентів ,1 моль/л (КH3PO4 = 6.2*10-8) при доливанні до нього 20 мл розчину лугу з молярною концентрацією еквівалентів 0,2 моль/л. 2.4.16. Гідрокарбонатна буферна система складається з 100 мл розчину гідрокарбонату натрію з молярною концентрацією еквівалентів 0,1моль/л і 100 мл карбонату натрію з молярною концентрацією еквівалентів 0,2моль/л. (КН2СО3=4,13*10-7) Визначити рН даної системи. 2. 4.17. Обчислити рН амонійного буфера, що складається із 400мл розчину NH4Cl з с0(NH4Cl)=0,15моль/л і 200 мл розчину аміаку з с0(NH3 · Н2О)=0,1моль/л. Кд(NH3 · Н2О)=1,8·10-5 моль/л. 2.4.18. Розрахувати кількості мл розчинів СН3СООН з с0(СН3СООН)=0,1 моль/л і СН3СООNa з с0(СН3СООNa)=0,1 моль/л, а також води, які необхідно змішати, щоб приготувати 400 мл ацетатного буфера з с(буфера)=0,05 моль/л і рН=5,24. Кд(СН3СООН)=1,75·10-5моль/л. У відповіді об’єми компонентів буфера виразити в літрах. 2.4.19. Обчислити рН ацетатного буфера, що складається із 50мл розчину СН3СООNa з с0(СН3СООNa)=0,1моль/л і 200 мл розчину СН3СООН з с0(СН3СООН)=0,05моль/л. Кд(СН3СООН)=1,75·10-5 моль/л. 2.4.20. Обчислити рН фосфатного буфера, що складається із 150мл розчину NaH2PO4 з с0(NaH2PO4)=0,1моль/л і 200 мл розчину Na2HPO4 з с0(Na2HPO4)=0,05моль/л. Кд(Н2РО4-)=6,2·10-8 моль/л. 2.4.21. Розрахуйте, які об’єми розчинів гідрокарбонату і карбонату натрію з молярними концентраціями еквівалентів 0,1 моль/л треба взяти для приготування 20 мл буферного розчину з рН=6,30 (КН2СО3=4,13*10-7) Як зміниться рН даного буферу при доливанні до нього 10 мл розчину лугу з молярною концентрацією еквівалентів 0,02 моль/л. а) V1 = 18 мл; V2 = 2 мл; рН = 6,50; б) V1 = 10 мл; V2 = 10 мл; рН = 7,35; в) V1 = 9 мл; V2 = 11 мл; рН = 6,65; г) V1 = 5 мл; V2 = 15 мл; рН = 9,9.
2.4.22. Розрахуйте, які об’єми розчинів гідрокарбонату і карбонату натрію з молярними концентраціями еквівалентів 0,1 моль/л треба взяти для приготування 20 мл буферного розчину з рН=6,30 (КН2СО3=4,13*10-7) Як зміниться рН даного буферу при доливанні до нього 10 мл розчину з молярною концентрацією еквівалентів 0,02 моль/л. а) V1 = 7 мл; V2 = 13 мл; рН = 9,9; б) V1 = 8 мл; V2 = 12 мл; рН = 6,50; в) V1 = 18 мл; V2 = 2 мл; рН = 7,35; г) V1 = 9 мл; V2 = 11 мл; рН = 6,65. 2.4.23. Розрахувати кількості мл розчинів Na2HPO4 з с0(Na2HPO4)=0,02 моль/л і NaH2PO4 з с0(NaH2PO4)=0,1 моль/л, а також води, які необхідно змішати, щоб приготувати 600 мл фосфатного буфера з с(буфера)=0,05 моль/л і рН=5,46. Кд(Н2РО4-) = 6,2·10-8 моль/л. У відповіді об’єми складових буфера виразити в літрах. 2.4.24. Розрахувати кількості мл розчинів Na2HPO4 з с0(Na2HPO4)=0,1 моль/л і NaH2PO4 з с0(NaH2PO4)=0,1 моль/л, а також води, які необхідно змішати, щоб приготувати 600 мл фосфатного буфера з с(буфера)=0,05 моль/л і рН=5,46. Кд(Н2РО4-) =6,2·10-8 моль/л. У відповіді об’єми складових буфера виразити в літрах. 2.4.25. Розрахувати кількості мл розчинів СН3СООН з с0(СН3СООН)=0,1 моль/л і СН3СООNa з с0(СН3СООNa)=0,1 моль/л, а також води, які необхідно змішати, щоб приготувати 300 мл ацетатного буфера з с(буфера)=0,1 моль/л і рН=5,46. Кд(СН3СООН)=1,75·10-5моль/л. У відповіді об’єми компонентів буфера виразити в літрах.
|










 ;
; ;
; ;
; ;
;