 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| СПОСОБИ ВИРАЖЕННЯ КОНЦЕНТРАЦІЇ РОЗЧИНІВ
Банк завдань до модуля-1 Для студентів спеціальності «Стоматологія» 1.1 Біогенні елементи. Метали та сплави в стоматології
І рівень 1.1.1. Біогенні елементи представлені у ряді: а) Ca, P, Mg, Fe, Mn; б) I, Zn, Cu, F, Fe; в) Co, Ni, K, Na, Mg; г) O, C, H, N, P, S. 1.1.2. ЙонNa+ має наступну електронну будову: а) 1s22s22p63s2; б) 1s22s22p63s1; в) 1s22s22p6; г) 1s22s22p5. 1.1.3. Метал, що знаходиться у природі в самородному стані- це: а) кальцій; б) алюміній; в) золото; д) залізо. 1.1.4. Для виготовлення золотих штампованих коронок використовують сплави золота: а) 583 проби; б) 900 проби; в) 750 проби; г) 385 проби. 1.1.5. До p-елементів відноситься наступний ряд: а) Na. Mg, Fe, S; б) Na, K, Mg, Ca; в) O, C, N. F; г)Cu, Co, Fe, Zn. 1.1.6. Якому d-елементу відповідає електронна конфігурація 3s23p63d64s2: а) Zn; б) Fe; в) Ag; г) Cu 1.1.7. Як змінюються металічні властивості в ряді елементів із порядковими номерами 4, 12, 20, 38, 56, 88? а) не змінюються; б) збільшуються; в) зменшуються; г) спочатку збільшуються, потім зменшуються. 1.1.8. Температура плавлення золота: а) 8900С; б) 10560С; в) 14000С; г) 12000С. 9. До d-елементів відносяться: а) Na. Mg, Fe, S; б) Na, K, Mg, Ca; в) O, C, N. F; г) Cu, Co, Fe, Zn. 1.1.10. Електронна формула має вигляд 1s22s22p63s23p6для атома: а) P+5; б) Ar; в) Ca+2; г) Br+7. 1.1.11 Який з перелічених металів здатний витісняти Гідроген із води за кімнатної температури: а) мідь; б) залізо; в) цинк; г) натрій. 1.1.12. Які проби сплаву золота застосовуються в ортопедичній стоматології? а) 900, 750 з платиною; б) 750 як припій; в) 583; г) 1000. 1.1.13. До макроелементів (більше 0,01%) можна віднести – а) F, Mg, Fe, Cd; б) Na, K, Сl, Ca; в) Ca, Cu, Au, N; г) Mn, Co, Fe, Zn. 1.1.14. Якому d-елементу відповідає електронна конфігурація 3s23p63d74s2 а) Zn; б) Fe; в) Ag; г) Co. 1.1.15. Найпоширенішим металом у земній корі є: а) Fe; б) Al; в) Ca; г) Na. 1.1.16. Під час виготовлення золотого припою для зниження температури плавлення використовують: а) хром; б) вольфрам; в) кадмій; г) олово. 1.1.17. Елементи-органогени записані у ряді: а) N, P, K, Mg, Cl; б) C, H, O, Ca, F, Br; в) C, H, O, N, P, S; г) N, P, S, Ba, O, F. 1.1.18. Якому d-елементу відповідає електронна конфігурація 3s23p63d54s1: а) Zn; б) Fe; в) Ag; г) Cr. 1.1.19. Гіпс стає пластичним при змішуванні його з водою: а) 1:1; б) 1:2; в) 1:3; г) 1:4. 1.1.20. Який склад нержавіючої сталі? а) залізо /основа/, хром, нікель, кремній, марганець, вуглець; б) залізо /основа/, хром, нікель, титан, кремній, вуглець; в) хром /основа/, нікель, титан, вуглець; г) титан /основа/, залізо, марганець, кобальт. 1.1.21. До мікроелементів (10-2 – 10-12%) відносять: а) Na, K, Сl, Ca, C; б) Mg, Zn, Сu, Fe, J; в) Ca, Cu, Au, N, F; г) Mn, Cd, Ag, Cl, О. 1.1.22. Якому d-елементу відповідає електронна конфігурація 3s23p63d104s2 а) Zn; б) Fe; в) Ag; г) Cu. 1.1.23. Які властивості проявляють оксид і гідрат оксиду Fe у ступені окиснення +2: а) кислотні; б) основні; в) амфотерні. 1.1.24. Сплав золота 750 проби використовують для виготовлення: а) проміжної частини мостоподібних протезів; б) штампованих коронок; в) металокерамічних каркасів; г) литих коронок. 1.1.25. До незаміннихелементів відносять: а) Na, K, Сl, Ca, Cd; б) Mg, Zn, Сu, Fe, Hg; в) Ca, Cu, Au, N, F; г) C, H, O, N, Ca, 1.1.26.Якому d-елементу відповідає електронна конфігурація 3s23p63d24s2 а) Zn; б) Fe; в) Ag; г) Ті. 1.1.27. Як змінюються металічні властивості від елемента з порядковим номером 11 до елемента під номером 18: а) не змінюються; б) збільшуються; в) зменшуються; г) спочатку збільшуються, потім зменшуються. 1.1.28. Значення кадмію в сплаві золота: а) підвищення температури плавлення; б) зниження температури плавлення; в) надання кольору; г) надання рідинотекучості. 1.1.29. До біокаталітичних елементів відносяться: а) Na. Mg, Fe, S, Р; б) Na, K, Mg, Ca, Ва; в) Cu, Zn, Mn, Co, Fe; г) O, C, N. F, Н. 1.1.30. Зовнішній енергетичний рівень якого елемента описується формулою … 5s24d3: а) Nb; б) Rb; в) As; г) Sb. 1.1.31. Єдиним рідким металом за звичайних умов є: а) манган; б) ванадій; в) ніобій; г) ртуть. 1.1.32. Для прискореного процесу затвердіння гіпсу можна використати як каталізатор: а) 5-6% розчину цукру; б) 5%- розчину етилового спирту; в) 3%- розчину кухонної солі; г) 2-3% розчину бури. 1.1.33. До s-елементів відноситься наступний ряд: а) Na, Fe, Co, Ni, As; б) Na, K, Ca, Mg, Ba; в) Na, K, Rb, Hg, Sb; г)H, N, O, S, P. 1.1.34. Елемент Флуор має наступну електронну будову: а) 1s22s22p63s2; б) 1s22s22p63s1; в) 1s22s22p5; г) 1s22s22p6. 1.1.35. Які властивості проявляють оксид і гідрат оксиду Fe у ступені окиснення +3: а) кислотні; б) основні; в) амфотерні. 1.1.36. Температура плавлення заліза: а) 15390С; б) 19390С; в) 18000С; д) 14500С. СПОСОБИ ВИРАЖЕННЯ КОНЦЕНТРАЦІЇ РОЗЧИНІВ
1.2.1. Розчин, в якому речовина при певній температурі більше не розчиняється, називають: а) насичений; б) ненасичений; в) розведений; г) пересичений.
1.2.2. В шлунковому соці людини розчиненою речовиною є: а) соляна кислота; б) натрій гідроксид; в) вода; г) сірчана кислота.
1.2.3. Щоб збільшити розчинність газу, треба: а) понизить температуру; б) підвищити температуру; в) підвищити тиск; г) понизить тиск.
1.2.4. При збільшенні температури,розчинність речовини: а) зменшується; б) збільшується; в) не змінюється; г) спочатку збільшується, а потім зменшується.
1.2.5. Тиск впливає на розчинність речовини: а) рідкої; б) твердої; в) газоподібної; г) нерозчинної.
1.2.6. Вибрати фактор, який збільшує розчинність твердих речовин: а) пониження температури; б) підвищення температури; в) підвищення тиску; г) пониження тиску.
1.2.7. Хлорид натрію розчиняється у воді і не розчиняється в бензолі. Це пояснюється: а) різною природою хімічного зв’язку у молекулах води і бензолу; б) різною густиною води і бензолу; в) різними ступенями окиснення атомів гідрогену у воді і у бензолі; г) різними молярними масами у води і бензолу.
1.2.8. Вибрати формулу для знаходження масової концентраціїрозчину: а) Cm = в) Cн = 1.2.9. Вибрати формулу для знаходження молярної концентраціїрозчину: а) в) Cн =
1.2.10. Вибрати формулу для знаходження молярної концентрації еквівалентів розчину: а) Cm = в) Cн =
1.2.11. Формула для обчислення моляльностіводних розчинів: а) Сm = в)
1.2.12. Моляльна концентрація (моляльність) – це відношення кількості розчиненої речовини (моль) до: а) маси розчину; б) об’єму розчину; в) маси розчинника; г) об’єму розчинника.
1.2.13. Масова частка розчиненої речовини в розчині позначається як: а) ν; б) СМ; в) ρ; г) ω.
1.2.14. Масова частка розчиненої речовини в розчині виражається в: а) г/л; б) моль/л; в) г/дм3; г) %.
1.2.15. “Визначити масову частку речовини в розчині” означає: а) знайти масу речовини, розчинену в 100 г води; б) знайти масу речовини, розчинену в 100 г розчину; в) знайти масу речовини в певній масі розчину; г) знайти масу речовини в певному об’ємі розчину.
1.2.16. Молярна концентрація розчиненої речовини позначається як: а) ν; б) СМ; в) ρ; г) ω.
1.2.17. Молярна концентрація розчиненої речовини виражається в: а) г/л; б) моль/л; в) г/дм3; г) відсотках (%)
1.2.18. Вибрати позначення одномолярного розчину: а) 1 М; б) 2 н; в) 1 дм3; г) 1%.
1.2.19. Титр розчину визначає: а) кількість г в 1 мл розчину; б) кількість молів в 1 л розчину; в) кількість г в 100 мл розчину; г) кількість г в 1 л розчину. 1.2.20. Фізіологічний розчин – це: а) 0,5%- розчин NaCl; б) 5%- розчин NaCl; в) 0,9%- розчин NaCl; г) 8%- розчин глюкози.
1.2.21. Фізіологічний розчин – це:?????? а) 0,5%- розчин NaCl; б) 5%- розчин NaCl; в) 9%- розчин NaCl; г) 5%- розчин глюкози.
1.2.22. Який фактор еквівалентності для сполуки фосфатної кислотив реакція, які йдуть до кінця: а) 1/1; б) ½; в) 1/3; г) ¼.
1.2.23. Який фактор еквівалентності для сульфатної кислотив реакція, які йдуть до кінця: а) 1/1; б) ½; в) 1/3; г) ¼.
1.2.24. Який фактор еквівалентності для сполуки гідроксиду хрому(ІІІ) в реакція, які йдуть до кінця: а) 1/1; б) ½; в) 1/3; г) ¼.
1.2.25. Який фактор еквівалентності для сполуки гідроксиду амоніюв реакція, які йдуть до кінця: а) 1/1; б) ½; в) 1/3; г) ¼.
1.2.26. Який фактор еквівалентності для сполуки натрію хлориду в реакціях обміну, які йдуть до кінця: а) 1/1; б) ½; в) 1/3; г) ¼.
1.2.27. Який фактор еквівалентності для натрію карбонату: а) 1/1; б) ½; в) 1/3; г) ¼.
1.2.28. Який фактор еквівалентності для натрію гідрокарбонату: а) 1/1; б) ½; в) 1/3; г) ¼.
1.2.29. Який фактор еквівалентності для сполуки хлориду алюмінію: а) 1/1; б) ½; в) 1/3; г) ¼.
1.2.30. Який фактор еквівалентності для сполуки хлориду барію в реакціях обміну, які йдуть до кінця: а) 1/1; б) ½; в) 1/3; г) ¼.
1.2.31. Який фактор еквівалентності для сполуки купруму сульфату в реакціях обміну, які йдуть до кінця: а) 1/1; б) ½; в) 1/3; г) ¼.
1.2.32. Який фактор еквівалентності для амонію сульфату: а) 1/1; б) ½; в) 1/3; г) ¼.
1.2.33 Молярна маса еквіваленту сульфатної кислотив реакціях повного йонного обміну становить (в г/моль): а) 98; б) 4,9; в) 49; г) 9,8.
1.2.34. Молярна маса еквіваленту фосфатної кислотив реакціях повного йонного обміну становить (в г/моль): а. 98; б. 49; в. 24,5; г. 32,67.
1.2.35. Молярна маса еквіваленту гідроксиду амонію в реакціях обміну становить (в г/моль): а) 78; б) 39; в) 35; г) 19,5.
1.2.36. Молярна маса еквіваленту сульфату амонію в реакціях обміну рівна (в г/моль): а) 114; б) 57; в) 342; г) 171. 1.2.37. Молярна маса еквіваленту фосфату кальцію в реакціях повного йонного обміну становить (в г/моль): а) 51,67; б) 310; в) 155; г) 103,33;
1.2.38. В хірургії для дезінфекції рук використовують розчин: а) мурашиної кислоти; б) NaОН; в) NaCl; г) Н2SО4; ІІ рівень 2.2.1. Яку масу калій перманганату необхідно взяти для приготування 200 мл 0,2 моль/л розчину? 2.2.2. Обчислити молярну концентрацію натрій хлориду с(NaCl) в розчині з масовою часткою натрій хлориду 10%, якщо густина розчину 1г/мл. 2.2.3. Молярна концентрація еквівалента натрій карбонату с(-Na2CO3)=0,1 моль/л. Обчислити масу карбонату натрію в 520мл розчину. 2.2.4. В 200мл розчину міститься 4,9г сульфатної кислоти. Розрахувати молярну концентрацію еквівалента сульфатної кислоти с(-H2SO4) 2.2.5. Обчислити масу води, яку необхідно додати до 50г розчину перманганату калію з масовою часткою перманганату калію 5%, щоб одержати розчин з масовою часткою перманганат калію 0,1%. 2.2.6. Молярна концентрація еквівалента сульфатної кислоти с(-H2SO4)=0,02моль/л. Розрахувати масову концентрацію сульфатної кислоти ρ(H2SO4) 2.2.7. До 50г спиртового розчину йоду з масовою часткою йоду 1% додали 2г йоду. Обчислити масову частку йоду в одержаному розчині. 2.2.8.. Для приготування 100г розчину глюкози з масовою часткою 5% треба: 2.2.9. Для приготування 200г розчину гідрокарбонату натрію з масовою часткою 1,5 % потрібно: 2.2.10. Для приготування 400г розчину глюкози з масовою часткою 4,5% потрібно: 2.2.11. В 191 мл води розчинили 9 г глюкози. Розрахувати масову частку глюкози в розчині 2.2.12. Масова частка соляної кислоти в шлунковому соці рівна 0,5% (ρ=1,007г/см3) Яка молярна концентрація еквівалентів кислоти в шлунковому соці? 2.2.13..Яка маса кристалічної соди (Na2CO3* 10H2O) потрібна для приготування 250 мл розчину з молярною концентрацією 0,5 моль/л? Який титр приготованого розчину? 2.2.14. Для приготування 250 см3 розчину хлориду кальцію з молярною концентрацією 0,1 моль/дм3 потрібно: 2.2.15. Яка молярна концентрація еквівалентів солі в розчині, якщо в 400 мл розчину розчинено 8,1 г Na2CO3? Розрахувати масову частку даного розчину, якщо ρ=1,002 г/мл. 2.2.16. Яка масова частка хлориду кальцію в 0,2 М розчині CaCl2 (ρ=1,005г/см3) і титр цього розчину? 2.2.17. Яка маса хлориду натрію потрібна для приготування 500 мл фізіологічного розчину (w=0,9%; ρ≈1 г/см3) Визначте полярність і титр розчину. 2.2.18. Який об’єм фізіологічного розчину (0,9 % NaCl, ρ= 1 г/мл) можна приготувати із 0,1 моля кухонної солі? 2.2.19. Для приготування 500 мл розчину сульфату алюмінію з молярною концентрацією еквівалентів солі 0,01 моль-екв/л потрібно: 2.2.20. Для приготування 200 мл розчину сульфату Купру му (ІІ) з молярною концентрацією еквівалентів 0,5 моль/л потрібно: 2.2.21. Для приготування 50 см3 розчину хлориду натрію з молярною концентрацією еквівалентів NaCl 0,143 моль-екв/л потрібно: 2.2.22. Встановити титр розчину, в 250 мл якого розчинено 3,6 г хлориду барію. Яка молярна концентрація еквівалентів солі в цьому розчині? |



 ; б)
; б)  ;
; г) ω =
г) ω = 
 ; б)
; б)  ; б) Bx =
; б) Bx =  ;
; ; г) ω =
; г) ω = 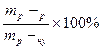 ;
;