 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Электролитическая диссоциация
Электролиз обязан своему существованию явлению электролитической диссоциации. Электролитическая диссоциация – явление распада нейтральных молекул на ионы. Процесс происходит следующим образом (рис 11.1): молекулы растворителя окружают молекулы вещества и разводят центры масс отрицательных и положительных зарядов до тех пор, пока не разорвутся химические связи, их соединяющие. Образования, которые получаются в результате (ионы вещества, окруженные дипольными молекулами растворителя), называются сольвататами, если растворитель – вода, то гидросольвататами.
Рис. 11.1. Проводимость электролитов Рассмотрим протекание электрического тока через раствор электролита на примере
Рассмотрим электролитическую ванну. Это устройство представляет собой ванну с электролитом, в которую опущены электроды. На электроды подается постоянное напряжение. Под действием электрических сил ионы начинают двигаться. Положительные ионы, которые движутся к катоду, называются катионами, отрицательные, движущиеся к аноду, – анионами.
Рис. 11.2. Основным отличием электролитов от металлов является, то, что носителями заряда в электролитах являются не только отрицательные, но и положительные частицы. Плотность тока в электролите можно представить как:
где α – коэффициент диссоциации.
где z – валентность.
Опыт 11.1.Проводимость электролита. Цель работы: Изучить проводимость электролитов. Оборудование: 1. Стакан дистиллированной воды 2. Электроды 3. Лампочка 4. Источник напряжения 5. Соединительные провода 6. Сахар, поваренная соль.
Рис.11.3.
Ход работы. В стакан с дистиллированной водой опущены два электрода, которые подсоединены к источнику напряжения. Последовательно к этому источнику подключена лампа накаливания. 1. Замыкают цепь источника. Несмотря на то, что на электродах имеется напряжение, лампа не горит. Дело в том, что в воде отсутствуют носители заряда. 2. В воде пробуют растворить сахар. Несмотря на то, что это легко удается, лампа по-прежнему не горит. Это объясняется тем, что при растворении сахара никаких ионов в воде не появляется. 3. В воду добавляют поваренную соль. После чего полосок лампочки слегка накалился. Пошел ток. Пробуют размешать соль в воде. Яркость свечения лампы увеличилась. При растворении поваренной соли в воде появляются положительно заряженные ионы натрия и отрицательно заряженные ионы хлора, которые и обеспечили проводимость раствора. Вывод: При растворении солей, кислот и щелочей в воде их молекулы диссоциируют, распадаются на ионы. Кроме нейтральных молекул в воде появляются положительно и отрицательно заряженные частицы-ионы. Поэтому, если в такой электролит опустить электроды и подать на них напряжение, то через электролит будет проходить электрический ток.
|





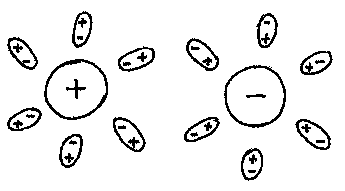
 (рис. 11.2). В водном растворе
(рис. 11.2). В водном растворе 




 называются подвижностью ионов, это физическая величина численно равная скорости ионов в единичном электрическом поле.
называются подвижностью ионов, это физическая величина численно равная скорости ионов в единичном электрическом поле.