ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
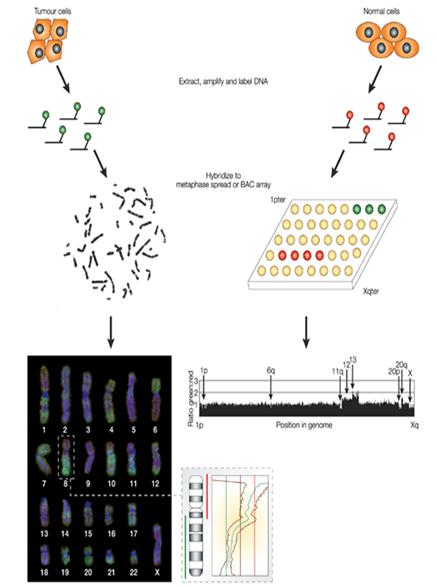
| Сравнительная геномная гибридизацияСледующей трансформацией цитогенетики является реализация широкого сканирования генома на потерю или увеличение хромосомного материала без прямого осмотра хромосом. Техника, которая делает это возможным, называется сравнительная геномная гибридизация (CGH), разработана командой Ollie и Anna Kallioniemi, Dan Pinkel и Joe Grey (1992). При этой методике конкурирующие за связывание образцы геномной ДНК метятся красным и зеленым цветом. Соотношение красная-зеленая флюоресценция измеряется вдоль длины каждой хромосомы. Хромосомные регионы, которые эквивалентно гибридизуются с двумя образцами выглядят оранжевыми, а те, которые делетированы или амплифицированы - более красными или более зелеными. Техника CGH используется для изучения цитогенетики рака, например, CGH идентифицируют PIK3CA, каталитическую субъединицу фосфатидилинозитол3-киназы (PI3A), как онкоген рака яичников. ДНК-амплификационная техника также развивается для поиска генетических изменений в редких клетках, например, в «рогатых» клетках крови, являющихся предвестниками метастазирования опухоли. Исследуемая ДНК – «тест-ДНК», контрольная – «референс-ДНК» (например, исследуемая ДНК- ДНК из раковых клеток, контрольная ДНК – ДНК из здоровой ткани того же человека). Каждую из этих ДНК метят – тест – биотином, референс – дигоксигенином и смешивают в отношении 1:1. Далее проводят гибридизацию данной смеси с нормальными метафазными хромосомами любого здорового человека. После этого препарат обрабатывают авидином (он имеет высокое сродство к биотину и связан с зеленым флуорохромом) и антителами к дигоксигенину (дают красную флуоресценцию). Микроскопирование. В норме при отсутствии хромосомного дисбаланса красное = зеленому. Дупликация участка хромосомы или трисомия по хромосоме в тестируемой ткани: зеленое преобладает над красным. Делеция или моносомия приводит к преобладанию красного. Таким образом, оценивают интенсивность (отношение) зеленого и красного свечения. Если флуоресцентное отношение (ФО)=1 – норма; ФО больше 1 – увеличение повторов; ФО меньше 1 – потеря генетического материала. Пример: Если в качестве исследуемой ДНК, меченной зеленым, взять ДНК мужчины, а в качестве контрольной – ДНК женщины (мечена красным), то после их гибридизации с метафазными хромосомами ФО на Х-хромосоме будет около 0,5. Если ДНК мужчины пометить красным, а ДНК женщины – зеленым, то ФО будет равен 2.
Рисунок 4. Схема проведения сравнительной геномной гибридизации Преимущества данного метода: в одном эксперименте можно получить информацию об изменении количества ДНК по всему геному; не требует приготовления метафазных хромосом из исследуемой ткани; возможность анализа архивного материала (зафиксированных тканей). Недостатки: метод не чувствителен для выявления делеций, размеры которых менее 2 млн. п.н.; делеция должна быть представлена в 80% клеток и более. Чем она крупнее, тем в меньшем % клеток может быть представлена (но не менее 50%) и выявлена. Не выявляет инверсии и сбалансированные транслокации. В настоящее время развиваются методы множественной-CGH. При этой технике, метафазные хромосомы как мишени для гибридизации замещаются на микрочипы – последовательности ДНК (размером около 150 кб) определенных хромосом. Каждая такая последовательность клонируется (ПЦР) и помещается в искусственные бактериальные хромосомы (ВАС). Весь геном может быть помещен в 3000 BAC. Таким образом, множественная-CGH эквивалентна одновременному проведению тысячи FISH. Множественная-CGH обеспечивает лучшее определение количества копий и более точную информацию о точках поломки в сегментах, которые потеряны или увеличены, чем простая CGH. Что еще более важно, каждый клон – это точка доступа к геномной последовательности, в которой могут быть идентифицированы пораженные гены. Несмотря на то, что CGH нечувствительна к изменениям, которые встречаются с низкой частотой в анализируемых клетках, ожидается, что множественная-CGH позволит многим группам оценить большее число опухолей на текущие изменения, используя общую платформу. Этот анализ может обнаружить прогностические маркеры, идентифицировать новые опухоль-супрессирующие гены или онкогены и, наконец, глубже понять механизмы развития рака. Кроме того, автор предполагает, что некоторые пренатальные диагностические тесты, которые в настоящее время используют FISH, также могут быть дополнены вариантами CGH. Есть надежда, что прогрессивные технологии, такие как множественная-CGH, сократят время и стоимость цитогенетического анализа, что сделает его доступным большему числу семей. Новый метод в цитогенетике – сравнительный хромосомный пэйнтинг (Zoo-FISH).Районы гомологии хромосом разных видов выявляют с помощью гибридизации фрагментов ДНК отдельных хромосом одного вида на метафазных хромосомах других видов. Гомологичные районы выявляются в виде окрашенных участков – пэйнтов. Данный метод используют при анализе эволюции кариотипов. Примеры: пэйнтинговая проба хромосомы 2 человека при флуоресцентной гибридизации с хромосомами других видов приматов давала окрашенные участки на двух разных парах аутосом. Следовательно, в предковом кариотипе генетический материал второй хромосомы человека находился в двух разных хромосомах. Другой пример: гомолог р плеча хромосомы 2 человека у гориллы и орангутанга имеет перицентрическую инверсию, которой нет у человека и шимпанзе. Этой инверсии нет и у узконосой обезьяны. Следовательно, инверсия возникла после отделения общего предка гориллы и орангутанга от ветки, ведущей к человеку и шимпанзе. Предковым состоянием является неинвертированная форма короткого плеча второй хромосомы. Предполагаемый предковый кариотип приматов состоял из 25 пар хромосом и отличался от современного кариотипа человека 8 крупными перестройками, в частности в виде единых блоков были 3/21, 14/15, а короткие и длинные плечи нынешних хромосом 2, 16, 19 были разделены. Проектное задание 1.5.1. Заполните таблицу «Основные этапы развития цитогенетики»
1.5.2. Дайте сравнительную характеристику методам окрашивания хромосом. Тесты рубежного контроля 1. С-окрашивание хромосом позволяет выявить А) участки хромосом, богатые ГЦ-парами нуклеотидов Б) участки хромосом, богатые АТ-парами нуклеотидов В) прицентромерный гетерохроматин хромосом Г) общее морфологическое строение хромосомы 2. R-окрашивание хромосом позволяет выявить А) участки хромосом, богатые ГЦ-парами нуклеотидов Б) участки хромосом, богатые АТ-парами нуклеотидов В) прицентромерный гетерохроматин хромосом Г) общее морфологическое строение хромосомы 3. G-окрашивание хромосом позволяет выявить А) участки хромосом, богатые ГЦ-парами нуклеотидов Б) участки хромосом, богатые АТ-парами нуклеотидов В) прицентромерный гетерохроматин хромосом Г) общее морфологическое строение хромосомы 4. Рутинное окрашивание хромосом позволяет выявить А) участки хромосом, богатые ГЦ-парами нуклеотидов Б) участки хромосом, богатые АТ-парами нуклеотидов В) прицентромерный гетерохроматин хромосом Г) общее морфологическое строение хромосомы 5. Фиксатор Кларка состоит из А) 1 части этилового спирта и 1 части конц. уксусной кислоты Б) 1 части этилового спирта и 3 частей конц. уксусной кислоты В) 3 частей этилового спирта и 1 части конц. уксусной кислоты Г) 1 части этилового спирта, 3 частей конц. уксусной кислоты и 6 частей формалина 6. Выявление перестроек хромосом и геномных мутаций в интерфазных клетках возможно с помощью А) рутинной окраски хромосом Б) дифференциальной окраски хромосом В) FISH-окраски хромосом Г) сравнительной геномной гибридизации 7. Сравнительная геномная гибридизации позволяет выявлять: А) инверсии хромосом Б) незначительные (по размерам) делеции и дупликации В) геномные мутации Г) протяженные делеции и дупликации 8. Продольное расщепление хромосом в митозе впервые описал А) Флеминг Б) Чистяков В) Тио и Леван Г) Вейсман 9. Воспроизводимый метод получения метафазных хромосом человека был разработан А) Флеминг Б) Чистяков В) Тио и Леван Г) Касперсон 10. Первый метод дифференциального окрашивания хромсоом был разработан в 1968 году. Его автор А) Флеминг Б) Чистяков В) Тио и Леван Г) Касперсон |