 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| В) увеличить концентрации исходных веществ в 2 раза.
Решение. 1. Составим кинетическое уравнение реакции: V=k*C(NO)2*C(H2) 2.После уменьшения объема реакционной смеси в 2 раза концентрации реагентов увеличатся тоже в два раза. Тогда кинетическое уравнение примет вид: V/=k*(2C(NO))2*(2C(H2))=22*2 V=8 V. Как видно из расчетов, после уменьшения объема реакционной смеси в 2 раза скорость реакции возрастет в 8 раз. 3. Уменьшение давления в 2 раза приведет к соответствующему уменьшению концентраций реагентов. Кинетическое уравнение примет вид: V//=k*(1/2C(NO))2*(1/2C(H2))=(1/2)2*(1/2) V=1/8 V Из расчетов следует, что после уменьшения давления реакционной смеси в 2 раза скорость реакции уменьшится в 8 раз. 3.Увеличение концентраций исходных веществ в 2 раза приведет к эффекту, аналогичному при соответствующем уменьшении объема системы: V///=k*(2C(NO))2*(2C(H2))=22*2 V=8 V Т.о, после увеличения концентраций исходных веществ в 2 раза скорость реакции возрастет в 8 раз _____________________________________________________________________________
51.Объясните, как влияет повышение температуры, давления и концентрации исходных веществ на экзотермическую реакцию синтеза аммиака из простых веществ. Решение. 1. Запишем уравнение реакции синтеза аммиака из простых веществ: N2 (г)+3H2(г)=2NH3(г) Данная реакция является обратимой, гомогенной (все реагенты – газы,), протекает с уменьшением объема (в реакцию вступает 4 объема исходных газов-реагентов, получается 2 объема газообразного продукта). 2. Повышение температуры, давления и концентрации исходных веществ будет влиять на рассматриваемую реакцию в соответствии с законом Ле-Шателье: Если на систему, находящуюся в химическом равновесии, подействовать извне, то равновесие сместится в сторону реакции, компенсирующей внешнее воздействие. 3. Повышение температуры будет смещать равновесие в сторону обратной эндотермической реакции, протекающей с поглощением тепла. 4. Повышение давления будет смещать равновесие в сторону прямой реакции, протекающей с уменьшением объема реакционной смеси, т.е., с уменьшением давления. 5. Повышение концентраций исходных веществ(азота и водорода) будет смещать равновесие в сторону прямой реакции, ведущей к уменьшению этих концентраций. 6.Таким образом, из рассмотренных факторов повышение давления и концентраций исходных веществ будет благоприятно влиять на экзотермическую реакцию синтеза аммиака из простых веществ, способствовать увеличению ее выхода. Напротив, повышение температуры будет способствовать уменьшению выхода прямой реакции. _____________________________________________________________________________ 52.В биологическом полимере (белке) имеет место следующее превращение: нативное состояние ↔ денатурированное состояние, причем при повышении температуры равновесие сдвигается вправо. Сделайте вывод об энтальпии реакции (принцип Ле-Шателье). Решение. 1.Принцип Ле-Шателье гласит: Если на систему, находящуюся в химическом равновесии, подействовать извне, то равновесие сместится в сторону реакции, компенсирующей внешнее воздействие. 2. В соответствии с этим принципом при повышении температуры равновесие сдвигается в сторону эндотермической реакции, протекающей с поглощением тепла, т.е., с увеличением энтальпии реакции. 3. Поскольку, согласно условию, при повышении температуры равновесие сдвигается вправо , то прямая реакция (идущая вправо) – эндотермическая: нативное состояние ↔ денатурированное состояние, 53. Раствор содержит 20 г глюкозы в 100 г воды. Вычислите давление насыщенного пара растворителя над раствором при температуре 15 оС, если давление пара чистой воды при этой же температуре равно 23,75 мм рт. ст. Рассчитайте молярную долю растворителя. Решение 1.Рассчитаем молярные доли растворенного вещества и растворителя: 1.1.
Где
Тогда 1.2.Молярную долю растворителя,
тогда 2. Согласно закону Рауля, давление насыщенного пара растворителя над раствором пропорционально молярной доле растворителя:
где
_____________________________________________________________________________ 54. Водный раствор одноатомного спирта, содержащий 0,874 г вещества в 100 мл воды, замерзает при температуре -0,354 оС. Рассчитайте относительную молекулярную массу спирта и установите его формулу. Решение. 1. Согласно закону Рауля понижение температуры кристаллизации раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации растворенного вещества: ΔТзам.= Тзам (растворителя)- Тзам (раствора)=KСm (1) где Сm– моляльная концентрация раствора; К – криоскопическая постоянная. Для воды К=1,86° . В соответствии с условием задачи ΔТзам.=0 оС-(-0,354 оС)=0,354 оС. 2. Из выражения (1) найдем моляльную концентрацию растворенного вещества: Сm= ΔТзам/К=0,354/1,86=0,19 моль/кг 3.Согласно определению для моляльной концентрации:
Отсюда 3. Общая формула предельных одноатомных спиртов –СnH2n+1OH. ., тогда молярную массу спирта можно выразить следующим образом: М(R-OH)=14n+18=46, 14n=28, n =2. Следовательно, формула спирта – С2H5OH- этанол. _____________________________________________________________________________ 55.Осмотическое давление раствора объемом 250 мл, в котором содержится 20 г гемоглобина, равно 2855 Па (при 4 оСили 277 К).Установите молярную массу гемоглобина. Решение. 1. Согласно закону Вант-Гоффа осмотическое давление раствора прямо пропорционально молярной концентрации растворенного вещества: Росм=1000*R*T*См, па (1). Из выражения (1) найдем величину См: См= Росм/(1000*R*T)=2855/(1000*8,314*277)=0,00124 моль/л 2. Согласно определению молярная концентрация находится по формуле(2):
, отсюда 56.Водный раствор NaOH кипит при температуре 102,65 оС. Кажущаяся степень ионизации электролита равна 70%. Определите массу NaOH, растворённую в 100 г воды. Решение 1.Согласно закону Рауля повышение температуры кипения раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации растворенного вещества. Для растворов электролитов закон Рауля выглядит следующим образом (1): ΔТкип. = i*Кэ*Сm, ( 1) где i – поправочный изотонический коэффициент, Кэ – эбуллиоскопическая постоянная растворителя; для воды Кэ =0,52°; Сm –моляльная концентрация раствора; ΔТкип. = Ткип р-ра – Ткип.р-рителя. Согласно условию задачи ΔТкип=2,65° Найдем величину i: i=1+α(n-1), где α- кажущаяся степень ионизации электролита, согласно условию равна 0,7 n – количество ионов, на которые распадается в растворе 1 молекула электролита: NaOH=Na++OH- Т.О., для гидроксида натрия n=2. Тогда : i=1+α(n-1)=1+0,7*(2-1)=1,7 2.Из выражения (1) найдем величину Сm : Сm= ΔТкип/( i*Кэ)=2,65/(1,7*0,52)=3 моль/кг 3.Масса NaOH, растворённая в 100 г воды, определяется по формуле (2): m(NaOH)= Сm*M(NaOH)*100/1000 (2), где M(NaOH)=40 г/моль. Подставляя результаты расчетов в формулу (2), получаем: m(NaOH)=3*40*100/1000=12 г 57.Раствор, содержащий 2,1 г КОН в 250 мл воды, замерзает при -0,514 оС. Рассчитайте изотонический коэффициент и кажущуюся степень диссоциации Решение 1.Согласно закону Рауля понижение температуры замерзания раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации растворенного вещества. Для растворов электролитов закон Рауля выглядит следующим образом (1): ΔТзам. = i*К*Сm, ( 1) где i – поправочный изотонический коэффициент; К – криоскопическая постоянная растворителя; для воды К =1,86°; Сm –моляльная концентрация раствора; ΔТзам. = Тзам.р-рителя –Тзам. р-ра . Согласно условию задачи ΔТзам=0,514° Найдем величину Сm. Согласно определению для моляльной концентрации:
2.Из выражения (1) найдем величину изотонического коэффициента: I = ΔТзам./( К*Сm)= 0,514/(1,86*0,15)=1,84 3.Изотонический коэффициент и кажущаяся степень диссоциации связаны соотношением (2):
i=1+α(n-1), где α- кажущаяся степень ионизации электролита, n – количество ионов, на которые распадается в растворе 1 молекула электролита: КОН=К++ОН- Для гидроксида калия n=2. Выразим величину α: α=(i-1)/( n-1)=(1,84-1)/(2-1)=0,84=84%. 58. Осмотическое давление 0,5 М раствора карбоната калия равно 2726 кПа при 0 оС. Вычислите кажущуюся степень диссоциации K2CO3 в растворе. Решение 1.Согласно закону Вант-Гоффа для электролитов осмотическое давление раствора прямо пропорционально молярной концентрации растворенного вещества: Росм=i*1000*R*T*См, где i – изотонический коэффициент Найдем величину i: i= Росм/1000*R*T*См=2726000/(1000*8,314*273*0,5)=2,4 2.Изотонический коэффициент связан с кажущейся степенью ионизации соотношением :
i=1+α(n-1), где α- кажущаяся степень ионизации электролита, n – количество ионов, на которые распадается в растворе 1 молекула электролита: К2СО3=2К++СО32- Для карбоната калия n=3. Выразим величину α: α=(i-1)/( n-1)=(2,4-1)/(3-1)=1,4/2=0,7=70%. 59.Определить, какая доля радиоактивного изотопа актиния Решение 1. Согласно основному закону радиоактивного распада
где N- число нераспавшихся ядер в момент времени t ( по условию задачи – через 6 суток или 518400 с), α =1 - 2. Найдем постоянную радиоактивного распада
где Тогда 3. В соответствии с соотношением (1) рассчитаем α: α= Ответ: в течение 6 суток распадется 34,7% радиоактивного изотопа актиния 225. ______________________________________________________________________ 60.Найти отношение удельной активности стронция Решение. 1. Удельная активность образца определяется по следующей формуле: А=λ*NA /M, где λ - постоянная радиоактивного распада, с-1, NA – число Авогадро, M – молярная масса. Выведем формулу для нахождения отношения удельных активностей (формула 1):
где 2.Учитывая, что постоянная радиоактивного распада связана с периодом полураспада соотношением (2): λ = 0,693/Т1/2 (2), а периоды полураспада стронция 90 и радия 226 равны, соответственно, 28 лет и 1620 лет, по формуле (2) найдем
3.Подставляем полученные значения постоянных радиоактивного распада
Ответ: удельная активность изотопа стронция -90 выше, чем у изотопа радия -226 , в 144,76 раз. 61.Мощность экспозиционной дозы Dэ γ-излучения на расстоянии r1 = 40 см от точечного источника равна 4,3мкА/кг. Определить время t, в течение которого можно находиться на расстоянии r2 = 6 м от источника, если предельно допустимую экспозиционную дозу принять равной Do=5,165 мкКл/кг. Поглощением γ-излучения в воздухе пренебречь Решение 1. Время t, в течение которого можно находиться на расстоянии r2 от точечного источника, рассчитывается по формуле:
где 2. Выразим величину Р. Для точечного источника мощность экспозиционной дозы Dэ прямо пропорциональна мощности экспозиционной дозы на расстоянии, равном единице, и обратно пропорциональна квадрату расстояния до точки облучения (r1= 40 см):
Р= Dэ*r12 (2) 3. Подставим выражение (2) в выражение (1):
|



 0
0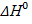 >0
>0
 ,
, -количество вещества глюкозы, рассчитывается по формуле:
-количество вещества глюкозы, рассчитывается по формуле: 20/180=0,11 моль
20/180=0,11 моль - количество вещества воды, рассчитывается по формуле
- количество вещества воды, рассчитывается по формуле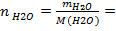 100/18=5,56 моль.
100/18=5,56 моль. , рассчитаем на основании соотношения:
, рассчитаем на основании соотношения: =1,
=1, =1-
=1- 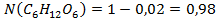
 ,
, - давление пара чистого растворителя (воды),
- давление пара чистого растворителя (воды),  - мольная доля чистого растворителя (воды). Подставляя данные задачи и расчетов, получаем:
- мольная доля чистого растворителя (воды). Подставляя данные задачи и расчетов, получаем: =23,75*0,98=23,275 мм рт.ст.
=23,75*0,98=23,275 мм рт.ст. ,
, =0,874/(0,19*0,1)=46 г/моль
=0,874/(0,19*0,1)=46 г/моль
 =20/(0,00124*0,25)=64516 г/моль.
=20/(0,00124*0,25)=64516 г/моль. =2,1/(56*0,25)=0,15 моль/кг
=2,1/(56*0,25)=0,15 моль/кг распадется в течение времени t = 6 суток
распадется в течение времени t = 6 суток ,
,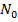 - число нераспавшихся ядер в момент времени, принятый за начальный (t=0),
- число нераспавшихся ядер в момент времени, принятый за начальный (t=0), 
 - постоянная радиоактивного распада. Тогда доля радиоактивного изотопа (α), которая распадется в течение времени t, может быть найдена по формуле (1):
- постоянная радиоактивного распада. Тогда доля радиоактивного изотопа (α), которая распадется в течение времени t, может быть найдена по формуле (1): (1)
(1) из соотношения 2:
из соотношения 2: ,(2)
,(2) - период полураспада актиния 225, равный 10 суток или 864000 с.
- период полураспада актиния 225, равный 10 суток или 864000 с. ,
, =0,347=34,7%
=0,347=34,7% к удельной активности радия.
к удельной активности радия. 
 (1)
(1) 226 г/моль и
226 г/моль и  90 г/моль
90 г/моль и
и  :
:

 в формулу(1) для нахождения отношения удельных активностей:
в формулу(1) для нахождения отношения удельных активностей:
 (1)
(1) - предельно допустимая экспозиционная доза излучения, падающего за время t на объект, находящийся на расстоянии 6 м от источника, Р –мощность экспозиционной дозы на расстоянии, равном единице. Согласно условию,
- предельно допустимая экспозиционная доза излучения, падающего за время t на объект, находящийся на расстоянии 6 м от источника, Р –мощность экспозиционной дозы на расстоянии, равном единице. Согласно условию,  =
= 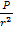 Отсюда:
Отсюда: