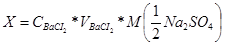ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Самостійна робота на занятті.
Виконати лабораторні роботи: 1. Визначення концентрації соляної кислоти методом кондуктометричного титрування. 2. Визначення концентрації йону SO42-. 3. Визначення соляної і оцтової кислот при кондуктометричному титруванні їх суміші. Методика виконання роботи Робота 1. Визначення концентрації соляної кислоти методом кондуктометричного титрування. Спочатку визначимо сталу електродної посудини вимірявши опір розчину КСІ відомої концентрації і електропровідності.
В електродну посудину наливають 10 мл досліджуваного розчину НСІ. Перемішування розчину здійснюють механічно чи за допомогою магнітної мішалки. Вимірюють опір досліджуваного розчину за допомогою омметра. Із бюретки порціями 0,5 мл до розчину додають робочий розчин NaOH. Після кожної порції титранту розчин перемішують і вимірюють його опір. При додаванні титранту опір спочатку буде зростати, а потім зменшуватись. Результати вимірювання заносять в таблицю:
На основі одержаних значень опору (R) розраховують питому електропровідність і будують графік залежності її від об’єму титранту. Знаходять точку еквівалентності на перетині кривих титрування. Визначивши за графіком еквівалентний об’єм NaOH знаходим молярну концентрацію еквіваленту за основним рівнянням титрування: СK*VК=CЛ*VЛ Робота 2. Визначення концентрації йону SO42-. Визначення концентрації йону SO42-, який володіє достатньо високою рухливістю грунтується на тому, що в процесі додавання титранту ВаСІ2 проходить утворення осаду SO42- + Ва2+ = ВаСІ2¯ При цьому електропровідність зменшується через зменшення в розчинів йонів SO42-, а після досягнення точки еквівалентності починає зростати внаслідок появи надлишку йонів Ва2+, які мають більшу електропровідність. В електродну посудину наливають 10 мл досліджуваного розчину Na2SO4, вимірюють його опір за допомогою омметра титрують із бюретки стандартним розчином ВаСІ2 порціями по 0,2 мл , перемішують і фіксують значення опору в таблиці. Електропровідність розчину в процесі титрування спочатку зменшується, а після одержання точки еквівалентності зростає. За результатами титрування будують графік залежності в координатах V®R і за одержаним графіком знаходять точку еквівалентності. Вміст сульфату натрію в грамах знаходять за формулою:
Робота 3. Визначення концентрацій соляної і оцтової кислот при кондуктометричному титруванні їх суміші. В електродну посудину наливають 10 мл суміші розчинів кислот (НСІ + СН3СООН) приблизно рівних концентрацій. Титрування ведуть 0,1 М розчином NaOH порціями вимірюючи опір. Точка кінця титрування соляної кислоти відповідає різкому зростанню електропровідності після її закономірного зниження. Точка ж кінця титрування оцтової кислоти відповідає злому на кривій титрування, що свідчить про перехід зростаючих значень електропровідності у постійні. Графічно знайшовши точки еквівалентності (аналогічно роботі №1) відповідно об’єми титранту, використані на нейтралізацію сильної кислоти (НСІ) і на нейтралізацію слабкої кислоти (СН3СООН), розраховують їх вміст в досліджуваній суміші. В протоколі даного досліду подати таблицю з результатами титрування, графік і розрахунки концентрацій кислот. ЗАНЯТТЯ №13 Тема: Потенціометрія Актуальність теми:Потенціометричний метод дозволяє визначити концентрацію йонів водню в розчинах і різних біологічних рідинах. Наявність доступних вимірювальних приладів робить цей метод широко використовуваним на практиці. Знання закономірностей виникнення електродних потенціалів, будови електродів, вимірювання рН середовища дає в руки медиків інструмент для діагностики і коректування важливого показника різних рідин внутрішнього середовища організму. Навчальні цілі: Знати: суть методу потенціометрії, який дозволяє визначити концентрацію йонів в різних середовищах, будову електродів, принцип вимірювання за допомогою потенціометра. Вміти: підготувати прилад до роботи, вимірювати рН різних розчинів і біологічних рідин, провести потенціометричне титрування і визначити концентрацію досліджуваного розчину. Самостійна позааудиторна робота студентів. 1. Механізм виникнення подвійного електричного шару. 2. Електродний потенціал, фактори від яких залежить його значення. 3. Рівняння Нернста для окисно-відновних систем. 4. Стандартні електродні потенціали. 5. Класифікація електродів. 6. Електроди визначення. Скляний електрод, йонселективні електроди. 7. Електроди порівняння. Водневий електрод. Хлорсрібний електрод. 8. Суть потенціометричного методу визначення рН розчинів і біологічних рідин. 9. Потенціометричне титрування. Які електроди при цьому застосовуються? 10. Криві потенціометричного титрування. Визначення точки еквівалентності графічним методом. 11. Застосування методу потенціометрії в медицині. 12. Зубні протези в стоматології. Проблеми гальванозу.
Контрольні питання. 1. Електродні потенціали, причини виникнення. 2. Рівняння Нернста. 3. Електроди 1 і 2-го роду. 4. Що таке стандартні електродні потенціали? 5. Будова і принцип дії водневого електроду. 6. Будова і принцип дії електроду порівняння. 7. Будова і принцип дії скляного електроду. 8. Будова і принцип дії мембранного електроду. 9. Як визначають стандартні електродні потенціали? 10. Що таке потенціометричне титрування? 11. Які складові необхідні для визначення рН розчину? 12. Як визначити точку еквівалентності при потенціометричному титруванні? 13. Що таке йонселективний електрод? 14. При потенціометричному титруванні до 20 мл розчину NaOH додавали по 1 мл розчину HCl C(HCl) = 0,15 моль /л. При цьому рН розчину змінювалось дуже повільно і до досягнення рН 9,7 було витрачено 14 мл розчину HCl. Після цього розчин HCl стали додавати порціями по 0,1 мл і при додаванні 0,4 розчину HCl рН різко змінився до 4,3. Розрахувати молярну концентрацію еквівалентів NaOH . |