ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Хімічний зв'язок у молекулах комплексних сполук
Розвиток уявлень про природу комплексних сполук тісно пов'язаний з розвитком загальної теорії хімічного зв'язку. Будова, фізико-хімічні та біологічні характеристики координаційних сполук залежать від природи і міцності зв'язку комплексоутворювача і лігандів. Із властивостей центрального іона найбільш важливе значення в процесі комплексоутворювання мають його електронна структура, ступінь окислення, іонний радіус, поляризуюча дія. Важлива роль у будові комплексних сполук належить також властивостям лігандів. Існує декілька підходів для описування хімічного зв'язку в молекулах координаційних сполук, але жодний з них не є універсальним. У більшості випадків вони доповнюють один одного, пояснюючи одні і ті ж питання з різних точок зору. На основі квантовомеханічних уявлень сучасна теоретична хімія пояснює утворення комплексних сполук за допомогою методу валентних зв'язків і методу молекулярних орбіталей. Метод валентних зв'язків. Згідно методу валентних зв'язків, утворення комплексних сполук відбувається за рахунок ковалентного зв'язку, утвореного по донорно-акцепторному механізму між комп-лексоутворювачем і лігандами. Функції донорів виконують атоми, що входять до складу лігандів, а роль акцептора відведено комплексоутворювачу, в якого є вільні орбіталі. Наприклад, утворення комплексного іона [ВеF4]2- відбувається за таким механізмом:
Іон Ве2+ має вільні 2s- і 2р-орбіталі, в межах яких розміщуються електронні пари фтору:
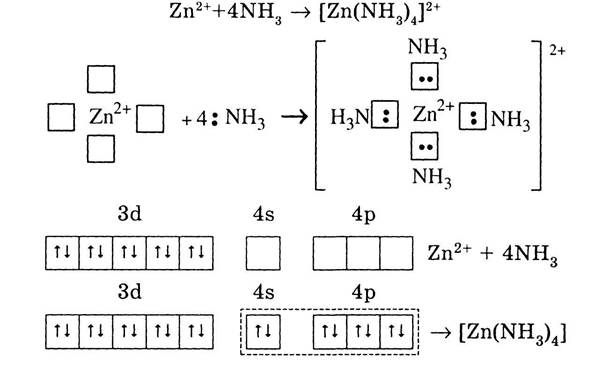
Аналогічно відбувається утворення [Zn(NH3)4]2+:
Штриховою лінією обведено електрони донорних атомів ліганда. Для Zn2+ характерне координаційне число 4, оскільки в реакції комп-лексоутворення приймають участь 4s- і 4р- орбіталі, утворюючи sр3-гібридизовані зв'язки. В утворенні ціанідового комплексу заліза (III) приймають участь дві 3d- орбіталі, одна 4s- і три 4р- орбіталі:
Дві вільні 3d- орбіталі утворюються внаслідок спаровування двох 3d- електронів. Таким чином у Fе3+ з'являється шість вільних гібридизованих орбіталей - d2sр3, що і обумовлює координаційне число 6. Наявність непарного 3d- електрона надає [Fе(СN3)6]3+ парамагнітних властивостей, тобто для цього іона характерним є високий магнітний момент. Якщо у складі комплексного іона всі електрони спарені, він буде слабко взаємодіяти з магнітним полем, тобто виявляти діамагнітні властивості як, наприклад, іон [Со(NН3)6]3+:
В графічних формулах комплексних сполук донорно–акцепторний зв’язок починається стрілкою, спрямованою від донора до акцептора:
За допомогою методу валентних зв'язків можна наочно уявити структуру і магнітні властивості комплексів, але важко пояснити їх оптичні властивості, дати оцінку енергії зв'язку. Метод молекулярних орбіталей. Цей метод описує хімічний зв'язок у комплексних сполуках - найкраще. В основі методу лежить уявлення про утворення молекулярних орбіталей комплексоутворювача і лігандів. Метод молекулярних орбіталей дозволяє дати оцінку розподілу електронної густини в комплексних сполуках, з'ясувати, які молекулярні орбіталі містяться в них і який їх енергетичний рівень. Молекулярні орбіталі поділяються на зв'язуючі, незв'язуючі та розпушуючі. Якщо енергія молекулярної орбіталі менша, ніж енергія вихідних атомних орбіталей, така орбіталь буде зв'язуючою. Молекулярна орбіталь, яка за рівнем енергії практично не відрізняється від атомної орбіталі комплексоутворювача, називається незв'язуючою. Молекулярна орбіталь з високим рівнем енергії є розпушуючою і розміщення на ній електронів призводить до послаблення хімічного зв'язку. В першу чергу електронами заповнюються зв'язуючі орбіталі; далі електрони, що залишилися, розподіляються між незв'язуючими і розпушуючими орбіталями. При утворенні зв'язків комплексоутворювач може використати s-, р- і d- орбіталі, а ліганди - тільки s- або р-орбіталі. Комплекс утворюється за рахунок сигма (σ)-зв'язків. Як приклад розглянемо розміщення електронів у високоспіновому [СоF6]3- і низькоспіновому [Со(NН3)6]3+ комплексах. У високоспіновому комплексі дванадцять електронів розміщені на шести зв'язуючих орбіталях σs, σp , σd, чотири - на незв'язуючих dхy , dхz, dyz і два - на розпушуючих σd*. У низькоспіновому комплексі [Со(NH3)6]3+, як і у випадку [СоF6]3-, дванадцять електронів розміщені на шести зв'язуючих орбіталях, в той час як шість електронів, що залишилися, - на трьох незв'язуючих. Тому комплекс [Со(NH3)6]3+ більш стійкий, ніж [СоF6]3-.
Рис. 1. Схема рівнів енергії МО для октаедричних комплексів: високоспінового [СоF6]3- та низькоспінового [Со(NH3)6]3+ Різниця енергій між незв'язуючими і розпушуючими орбіталями позначається як ∆. Від величини ∆ залежать властивості комплексних сполук. Якщо величина ∆ значна, електрони не підіймаються на високі рівні, а спаровуються на нижчих. Комплексні сполуки з високою ∆- діамагнітні, як, наприклад, [Со(NH3)6]3+.
|