 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Алгоритм выполнения задания Б
Изучение кинетики реакции разложения комплексного оксалата марганца удобно проводить, используя фотометрический метод, т.к. в этой реакции реагент ([Mn(C2O4)3]3−) окрашен в коричневый цвет, а получаемые продукты бесцветны. Стехиометрическое уравнение реакции имеет вид [Mn(C2O4)3]3− = Mn2+ +2,5C2O42− +CO2 , или если его представить в символьном виде: A → продукты. Известно, что кинетика разложения описывается уравнением первого порядка. Следовательно, интегральное кинетическое уравнение данной реакции будет иметь вид:
С учетом того, что между концентрацией комплексного оксалата марганца и оптической плотностью раствора наблюдается прямолинейная зависимость это уравнение преобразуется
В этом задании студент, не проводя опытов, обрабатывает имеющиеся экспериментальные данные о величине оптической плотности реакционных растворов в различные моменты времени. Методика определения константы скорости аналогична методике, рассмотренной ранее при выполнении задания А. Кроме нахождения величины константы скорости реакции (решения обратной кинетической задачи) нужно также выразить аналитически и построить графически зависимости концентрации вещества А от времени, т.е. кинетическую кривую. По ней нужно определить время полупревращения.
Материалы для самоподготовки ЗАДАЧА Рассчитать константу скорости реакции кристаллического фиолетового со щелочью по следующим данным:
Реакция проводилась при большом избытке щелочи:
КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Как интегрируется кинетическое уравнение односторонней (необратимой) реакции первого порядка? Как с помощью графика рассчитать константу скорости такой реакции? 2. Какой вид имеет кинетическое уравнение исследуемой реакции? 3. Какие приборы используются для определения оптической плотности окрашенных сред? Как измерить оптическую плотность раствора с помощью ЛМФ-69? 4. Как рассчитать константу скорости исследуемой реакции по зависимости оптической плотности рабочего раствора от времени?
Библиографический список
1. Химическая кинетика: Учебное пособие - практикум для лабораторных работ/Н.К. Булатов, А.Б. Лундин, Ю.Н. Макурин, Е.И. Степановских, Л.А. Брусницына, Т.А. Петухова - Екатеринбург: УГТУ−УПИ, 2007. −81 с. 2. Физическая химия. Электрохимия. Химическая кинетика и катализ: учеб.пособие для вузов: в 2 кн./ под ред. К. С. Краснова. - 3-е изд., испр. - М.: Высшая школа, 2001.Кн. 2. - 319 с. 3. Стромберг А. Г. Физическая химия / А. Г. Стромберг, Д. П. Семченко; под ред. А. Г. Стромберга ; 2-е изд., перераб. и доп. М. : Высш. шк., 2001. 496 с. 4. Определение параметров кинетических уравнений: учебное пособие/ Е. И. Степановских, Ю. Н. Макурин, Л. Н. Маскаева, И. М. Морозова.− Екатеринбург: УГТУ−УПИ, 2008. −73 с.
|



 .
. .
. , мин
, мин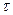 ,с
,с =
=  ;
; 
 . Температура 27oC .
. Температура 27oC .