 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Лекция 5 Основы молекулярной физики и термодинамики
План: 1. Уравнение молекулярно-кинетической теории идеальных газов. Уравнение Клапейрона-Менделеева. Молекулярное толкование термодинамической температуры. 2. Внутренняя энергия идеального газа. Работа газа при изменении его объема. Количество теплоты. Теплоемкость. Первое начало термодинамики. Применение первого начала термодинамики к изопроцессам и адиабатическому процессу идеального газа. Тезисы 1. Молекулярная физика и термодинамика — разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в телах атомов и молекул. Для исследования этих процессов применяют два качественно различных и взаимно дополняющих друг друга метода: статистический (молекулярно-кинетический) и термодинамический. Первый лежит в основе молекулярной физики, второй — термодинамики. Молекулярная физика — раздел физики, изучающий строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении. Молярная масса (масса 1 моль вещества) Постоянная Авогадро: nа = 6 • 1023 моль-1 (число молекул в 1 моле вещества) Молярная газовая постоянная (универсальная): R = p0V0/T0 = 8,31 Дж / (моль•К) Постоянная Больцмана (универсальная): k = R / NА = 1,38 • 10-23 Дж / К Число Лошмидта: NL = p0 / (kT0) = 2,68 • 1025 м-3 (число молекул, содержащихся в 1 м3 газа при н.у.) Законы, описывающие поведение идеальных газов (газовые законы) 1. Закон Бойля — Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная: pV = const при Т = const, m = const 2. Закон Гей-Люссака для изобарного процесса: объем данной массы газа при постоянном давлении изменяется линейно с температурой: V=V0 ( 1+a t ) при p = const, m = const или V1 / V2 = T1 / T2 при p = const, m = const, где V0 – объем при 00С, 3. Закон Гей-Люссака для изохорного процесса: давление данной массы газа при постоянном объеме изменяется линейно с температурой: p = p0 ( 1+a t ) при V = const, m = const или р1 / р2 = T 1/ T2 при V = const, m = const , где p0 – объем при 00С, 4. Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. При нормальных условиях (сокращенно: при н.у.) (р0 = 105 Па, T0 = 273 K) этот объем равен 22,41 • 10-3 м3/моль. 5. Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов: p = p1 + p2 + ... + pn , где p1,p2, ..., pn — парциальные давления — давления, которые оказывали бы газы смеси, если бы они одни занимали объем, равный объему смеси при той же температуре.
Уравнение Клапейрона (уравнение состояния идеального газа) Основное уравнение кинетической теории газов Кинетическая теория газов основана на следующих общих положениях классической статистической физики: в системе выполняются законы сохранения импульса, момента импульса, энергии, электрического заряда; предполагается возможность отличать друг от друга тождественные частицы; все физические процессы в системе протекают в пространстве и времени непрерывно; каждая частица системы может иметь произвольные значения координат и компонент скорости независимо от того, каковы значения этих характеристик у других. Основное уравнение кинетической теории газов Закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT / 2, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы
Внутренняя энергия идеального газа Теплоемкость Скорости, характеризующие состояние газа 1. Наиболее вероятная скорость 2. Средняя скорость молекулы 3. Средняя квадратичная скорость молекул
Работа А/, совершаемая внешними телами над системой, численно равна и противоположна по знаку работе А, совершаемой самой системой над внешней средой: Первый закон термодинамики: Теплота, сообщенная системе, идет на приращение внутренней энергии и совершение работы системой над внешними телами Молярная теплоемкость при постоянном объеме равна изменению внутренней энергии 1 моль газа при повышении его температуры на 1 К Молярная теплоемкость при постоянном давлении
Уравнение Майера Уравнение адиабаты (уравнение Пуассона)
Применение первого начала термодинамики к изопроцессам
|



 Молярный объем
Молярный объем  Количество вещества
Количество вещества  Концентрация (количество молекул в 1м3)
Концентрация (количество молекул в 1м3)  ,
, 




 Уравнение Клапейрона-Менделеева
Уравнение Клапейрона-Менделеева  или
или  или
или  или
или 
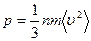 Средняя кинетическая энергия поступательного движения одной молекулы
Средняя кинетическая энергия поступательного движения одной молекулы  Число степеней свободы молекулы – это число независимых переменных, полностью определяющих положение системы в пространстве. Обозначение: I . Для одноатомного газа (гелий, водород): i = 3, двухатомного (кислород, азот): i = 5, многоатомного (углекислый газ, атмосферный воздух): i = 6. На каждую степень свободы молекулы приходится одинаковая энергия
Число степеней свободы молекулы – это число независимых переменных, полностью определяющих положение системы в пространстве. Обозначение: I . Для одноатомного газа (гелий, водород): i = 3, двухатомного (кислород, азот): i = 5, многоатомного (углекислый газ, атмосферный воздух): i = 6. На каждую степень свободы молекулы приходится одинаковая энергия 
 , где i — сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы: i = iпост + iвращ + 2 iколеб
, где i — сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы: i = iпост + iвращ + 2 iколеб или
или 
 Удельная теплоемкость
Удельная теплоемкость  Молярная теплоемкость
Молярная теплоемкость 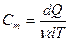 Связь между удельной и молярной теплоемкостями
Связь между удельной и молярной теплоемкостями 



 Полная работа, совершаемая газом при изменении его объема от V1 до V2
Полная работа, совершаемая газом при изменении его объема от V1 до V2  определяется площадью, ограниченной осью абсцисс, кривой p = f(V) и прямыми V1 и V2.
определяется площадью, ограниченной осью абсцисс, кривой p = f(V) и прямыми V1 и V2. , где dU - бесконечно малое изменение внутренней энергии системы, δA - элементарная работа, δQ - бесконечно малое количество теплоты. Первое начало термодинамики для 1 моль газа:
, где dU - бесконечно малое изменение внутренней энергии системы, δA - элементарная работа, δQ - бесконечно малое количество теплоты. Первое начало термодинамики для 1 моль газа: 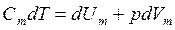





 или
или 
 Показатель адиабаты, или коэффициент Пуассона
Показатель адиабаты, или коэффициент Пуассона  Уравнение политропы
Уравнение политропы  Показатель политропы
Показатель политропы  (при С = 0, n = g - уравнение адиабаты; при С = ¥, n = 1 - уравнение изотермы; при С = СР, n = 0 - уравнение изобары; при С = Сv, n = ±¥ - уравнение изохоры).
(при С = 0, n = g - уравнение адиабаты; при С = ¥, n = 1 - уравнение изотермы; при С = СР, n = 0 - уравнение изобары; при С = Сv, n = ±¥ - уравнение изохоры).




 Работа газа меньше, чем при изотермическом
Работа газа меньше, чем при изотермическом Все количество теплоты, подводимое газу, расходуется на совершение им работы против внешних сил
Все количество теплоты, подводимое газу, расходуется на совершение им работы против внешних сил
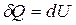 Теплота, сообщаемая газу, идет на увеличе-ние его внутрен-ней энергии
Теплота, сообщаемая газу, идет на увеличе-ние его внутрен-ней энергии Работа совершается за счет изменения внутренней энергии системы
Работа совершается за счет изменения внутренней энергии системы
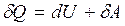

 Внутренняя энергия не меняется
Внутренняя энергия не меняется

