ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| ПРАВИЛА ОРИЕНТАЦИИ В БЕНЗОЛЬНОМ КОЛЬЦЕ
Существенной особенностью реакций получения и превращений производных ароматических углеводородов является то, что новые заместители вступают в бензольное кольцо в определенные положения по отношению к уже имеющимся заместителям. Закономерности, определяющие направление реакций замещения в бензольном ядре, называются правилами ориентации. Реакционная способность того или иного атома углерода в бензольном кольце определяется следующими факторами: 1) положением и природой уже имеющихся заместителей, 2) природой действующего агента, 3) условиями проведения реакции. Решающее влияние имеют два первых фактора. Заместители в бензольном кольце можно разделить на две группы. Электронодонорные (первого рода) — это группировки атомов, способные отдавать электроны. К ним относятся ОН, OR, RCOO, SH, SR, NH2, NHR, NR2, NHCOR, —N=N—, CH3, CH2R, CR3, F, CI, Br, I. Электроноакцепторные заместители (второго рода) — это атомные группировки, способные оттягивать, принимать электроны от бензольного ядра. К ним относятся S03H, N02, CHO, COR, COOH, COOR, CN, СС13, и т. д. Действующие на ароматические соединения полярные реагенты можно разделить на две группы: электрофильные и нуклеофильные. Наиболее характерны для ароматических соединений процессы алкилирования, галогенирования, сульфирования и нитрования. Эти процессы идут при взаимодействии ароматических соединений с электрофильными реагентами. Известны и реакции с нуклеофильными реагентами (NaOH, NH2Na и т. д.), например реакции гидроксилирования, аминирования. Заместители первого рода облегчают реакции с электрофильными реагентами, причем они ориентируют новый заместитель в орто- и пара-положения. Заместители второго рода затрудняют реакции с электрофильными реагентами: они ориентируют новый заместитель в мета-положение. В то же время эти заместители облегчают реакции с нуклеофильными реагентами. Рассмотрим примеры реакций с различными ориентирующим действием заместителей. 1. Заместитель первого рода; реагент электрофильный. Облегчающее реакцию действие заместителя, о-, п-ориентация:
2. Заместитель второго рода; реагент электрофильный. Затрудняющее реакцию действие заместителя; м-ориентация:
3. Заместитель первого рода; реагент нуклеофильный; м-ориентация. Затрудняющее действие заместителя. Примеры таких реакций с бесспорным механизмом неизвестны. 4. Заместитель второго рода; реагент нуклеофильный, о-, п-ориентация:
Систематические исследования влияния заместителей на ориентацию в бензольном кольце были проведены А. Голлеманом. Ф. Бейльштейн установил, что при наличии нескольких заместителей преобладающее направляющее действие оказывает тот из них, который обладает наибольшим активирующим эффектом. Важнейшие заместители по селективности ориентирующего действия в реакциях электрофильного замещения можно расположить в следующий ряд: NH2 > ОН > OR > CI > I > Br > CH3; COOH > S03H > N02. Описанные выше правила не носят характера законов. Речь почти всегда идет только о главном направлении реакции. Очень часто в реакции образуются все возможные продукты, однако преобладают количественно те из них, которые образуются в соответствии с правилами ориентации. Так, при нитровании толуола образуется 62% орто-, 33,5% пара- и 4,5% мета-нитротолуолов. Небольшое изменение условий проведения реакции замещения обычно не влияет на тип ориентации, однако изменяет соотношение между орто-и пара-изомерами. Значительное изменение условий, например сильное повышение температуры, оказывает влияние и на тип ориентации, так как изменяется механизм реакции. Так, например, бромирование толуола при обычной температуре дает преимущественно пара-изомер. При 400 °С соотношение между орто-, пара-, мета-изомерами 20, 57, 23%, а при 630 °С — 18,9, 21,2 и 59,9% (радикальное бромирование). Влияние растворителей незначительно. Катализаторы могут изменить направление процесса. Так, при бромировании хлорбензола обычно образуется всего 1 % мета-изомера. В присутствии А1С1з количество его возрастает до 13%. Механизм ориентирующего влияния заместителей. Как известно, в молекуле бензола имеет место совершенно равномерное распределение электронной плотности. Присутствие заместителя нарушает эту равномерность. Возникает чередующаяся полярность углеродных атомов в кольце — так называемый альтернирующий эффект. Заместитель может взаимодействовать с бензольным ядром двумя способами, могут иметь место два эффекта: индукционный (I) и сопряжения (М):
В первом случае изменение плотности в ядре связано с поляризацией σ-связи между заместителем и ядром (I). Эффект (М) связан с возникновением сопряжения между р-электронами заместителя и кольца. При этом возможны два случая: электроны могут смещаться в сторону кольца (I) или в сторону заместителя (II). В первом случае увеличивается реакционная способность бензольного кольца по отношению к электрофильным реагентам, во втором —по отношению к нуклеофильным реагентам. О существовании двух способов взаимодействия атомов говорит сравнение дипольных моментов производных бензола с соответствующими производными метана. Из данных табл. 14 видно, что для соединений с заместителями первого рода дипольные моменты у производных бензола меньше, чем у производных метана. При заместителях второго рода наблюдается обратная картина.
Таблица 14. Дипольные моменты производных метана и бензола, D*
Дипольный момент уменьшается, если два эффекта — индукционный и сопряжения — действуют в противоположных направлениях. Наоборот, при одинаковом направлении обоих эффектов дипольные моменты увеличиваются:
Таким образом, в зависимости от природы заместителя бензольное кольцо обогащается или обедняется электронной плотностью, т. е. становится более или менее склонным к электрофильному замещению. Реакции электрофильного замещения в ароматическом ряду обычно либо необратимые процессы, либо проводятся в условиях, далеких от равновесия. Поэтому их направление определяется не большей устойчивостью конечных продуктов по сравнению с исходными, а необходимой для их протекания энергией активации, т. е. не термодинамическими, а кинетическими факторами *. Эти реакции идут в направлении образования более выгодного переходного состояния, о структуре которого можно судить по реальной структуре промежуточного продукта — σ-комплекса (принцип Хэммонда). Следовательно, решающим фактором, определяющим направление электрофильного замещения, является влияние заместителя на устойчивость образующегося σ-комплекса. Вообще говоря, замещение может идти в любое положение бензольного кольца, однако с различной скоростью, определяемой различной энергией активации. Энергия активации тем меньше (а скорость реакции тем больше), чем выше устойчивость σ-комплекса, точнее, чем меньшая энергия требуется для возникновения соответствующего переходного состояния. Следовательно, качественный анализ ориентационного действия каждого заместителя сводится к анализу его влияния на устойчивость возникающего при реакции σ-комплекса. А поскольку главным фактором стабильности соединений является сопряжение, в первую очередь анализируется возможность максимального сопряжения при образовании σ-комплексов с участием различных атомов углерода бензольного кольца. Если сопряжение не позволяет решить вопрос об устойчивости σ-комплексов, то анализируется характер распределения электронной плотности с учетом того, что размещение одноименных зарядов у рядом стоящих атомов требует затраты большей энергии и, следовательно, является дестабилизирующим фактором. Роль энергетических факторов при выборе направления замещения демонстрирует рис. 60. Реакция пойдет преимущественно в условном положении 3, так как в этом случае ниже энергия активации.
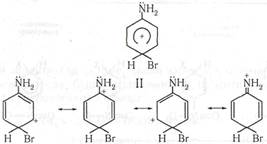
При электрофильном замещении заместители первого ряда повышают стабильность σ-комплексов, отвечающих о- и п-ориентации. Так, например, в случае галогенирования анилина стабилизируются сопряжением с участием аминогруппы только σ-комплек-сы I и II. В случае σ-комлпекса III такая стабилизация невозможна; бензольное кольцо не может принять электронную пару азота (нет сопряжения) и в соответствии с этим нельзя построить граничную структуру с положительным зарядом на атоме азота:
Граничные формулы отражают крайние состояния σ-комплекса. В действительности он существует в промежуточном «мезомерном» состоянии. При наличии в бензольном кольце заместителя второго рода сопряжение с этим заместителем в σ-комплексе невозможно, так как эти заместители не могут отдавать электроны для компенсации положительного заряда ядра. В этом случае относительно более выгоден σ-комплекс типа II, так как при его образовании не появляются два положительных заряда на рядом стоящих атомах, что исключительно невыгодно:
Таким образом, электронные эффекты облегчают или затрудняют взаимодействие реагентов с определенными атомами в бензольном кольце, изменяя устойчивость промежуточного σ-комплекса. При удалении заместителя, находящегося в боковой цепи, его ориентирующее влияние быстро ослабевает. Это, например, видно из опытных данных по нитрованию следующих нитропроизводных:
Ясно, что при наличии нескольких заместителей больше проявляется действие того из них, который способен вызвать большее смещение электронов и сильнее стабилизировать σ-комплекс. При наличии в соединении двух заместителей одного типа (первого или второго рода) согласованная ориентациях наблюдается только в том случае, когда они находятся в мета-положении:
При этом, если заместители разные, число изомеров, отвечающих влиянию каждого заместителя, будет различным. По ориентирующему влиянию заместители располагаются в ряды: NH2 > ОН > OR > OCOR > R > Hal; СООН > SO3H > N02. Примером могут служить результаты нитрования различных хлортолуолов (цифры показывают процентное содержание изомеров с данным положением заместителя):
Если в соединении имеется два заместителя различных типов (первого и второго рода), то согласованная ориентация будет при расположении их в орто- и пара-положении. Однако в этом случае ориентирует только заместитель первого рода, так как только он стабилизирует промежуточный σ-комплекс. Новый заместитель оказывается в орто— или пара - положении к заместителю второго рода, который ориентирует в мета-положение. Так, например, при нитровании м-нитротолуола (несогласованная ориентация) изомерные динитрбензолы образуются в следующих количествах:
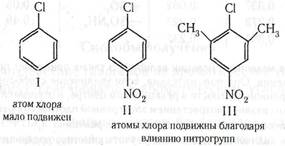
В рассмотренных нами случаях реагентами были ионы или сильно поляризованные молекулы. Иные соотношения наблюдаются в тех случаях, когда реагент представляет собой радикал. При атаке бензольного ядра радикалом не возникает кулоновского взаимодействия его с каким-либо определенным атомом углерода, так как радикал нейтрален. Таким образом, отсутствие ориентирующего влияния различных по природе заместителей может быть доводом в пользу признания для данной реакции радикального механизма. С сильным увеличением температуры ориентирующее влияние заместителей постепенно утрачивается, так как скорости всех трех процессов (о-, м- и п-замещения) выравниваются. Очень интересен, хотя еще мало изучен, вопрос о соотношении между о- и п-изомерами. Здесь следует учитывать несколько факторов: 1) в бензольном кольце о-положений два, п-положение одно; 2) в о-положении могут наблюдаться пространственные затруднения (например, при нитровании толуола образуется 58% о-изомера, при нитровании в тех же условиях трет-бутилбензола — 16% о- и 73% п-изомера; 3) индукционному влиянию особенно подвержены о-положения, так как оно сильно убывает по цепи. Следовательно, если заместитель индукционно дезактивирует бензольное кольцо, эта дезактивация проявляется более всего в о-положении. Пример — хлорирование хлорбензола; 4) эффект сопряжения по невыясненным причинам более всего проявляется в п-положении. Из рассмотренного видно, что наибольшее влияние на направление реакций ароматических соединений оказывает эффект сопряжения. Между тем сопряжение может существовать только в случае, если группы, которые могут участвовать в сопряжении, компланарны. Если оси облаков р-электронов заместителя и р-электронов бензольного кольца не параллельны, сопряжение ослабляется и заместитель теряет свое влияние на бензольное кольцо. Эта особенность эффекта сопряжения подтвеждена многими примерами. Ниже приведены компланарные системы
и система, выведенная из компланарности (атом хлора мало подвижен)
Корреляционный анализ.Полярное влияние на реакционный центр заместителей, находящихся в п- и м-положениях, может быть описано количественно с помощью корреляционного уравнения, предложенного Л. Гамметом:
где К — константа скорости или константа равновесия для замещенного соединения; Ко - аналогичная константа для незамещенного соединения; σ — константа, характеризующая полярное влияние заместителя; р— константа, определяющая степень чувствительности реакционного центра к полярным эффектам. Константа σ зависит только от природы заместителя, а константа р— от характера реакции. Соединения с различными заместителями, но с одним и тем же реакционным центром образуют реакционную серию. σ-Константы некоторых заместителей приведены в табл. 15. σ-Константа положительна, если заместитель оттягивает электроны, и отрицательна, если заместитель является донором электронов. Таблица 15. Значения σ-констант заместителей (по Мак-Даниэлю и Брауну) В зависимости от механизма реакции величина ртакже принимает положительные или отрицательные значения. Она положительна, если увеличение скорости реакции вызвано уменьшением электронной плотности в реакционном центре, и отрицательна, если увеличение скорости реакции связано с возрастанием электронной плотности в реакционном центре. Таким образом, по знаку р можно судить о механизме реакции. Для определения величины рдостаточно изучить кинетику превращений ряда соединений, входящих в данную реакционную серию . Для всех других соединений серии можно рассчитывать константы скорости реакции, используя значения σиз табл. 15. В настоящее время используется несколько систем реакционных констант а, учитывающих более тонкие взаимные влияния атомов. Установление возможности применения различных корреляционных уравнений называется корреляционным анализом. Для о-замещенных соединений простая корреляция обычно не наблюдается, так как о-заместптели влияют друг на друга не только индукционно, но и различными другими способами (стерический эффект, водородная связь, эффект поля и т. д.). Корреляционный анализ используется в органической химии для установления механизма реакций, строения реагирующих веществ.
|






















 При наличии в соединении любых двух заместителей в мета-положения появление нового заместителя между ними маловероятно по стерическим соображениям.
При наличии в соединении любых двух заместителей в мета-положения появление нового заместителя между ними маловероятно по стерическим соображениям.