ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| ЩЕЛОЧНЫЕ И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ.
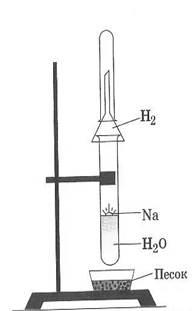
Опыт 1. Взаимодействие натрия с водой.
Маленький кусочек металлического натрия осторожно извлеките из керосина и опустите в пробирку с водой (см. рис). Соберите в пробирку выделяющийся газ и проверьте его тлеющей лучиной. К полученному раствору прибавьте 1 каплю фенолфталеина.
Визуальные наблюдения _______________________________________________ ____________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________
Опыт 2. Окрашивание пламени солями щелочных металлов. В пламени спиртовки несколько раз прокаливают нихромовую проволоку. Смачивают ее в растворе хлорида калия и вносят в пламя спиртовки. Наблюдают фиолетовое окрашивание. Проволоку промывают в соляной кислоте, хорошо прокаливают, затем смачивают в растворе соли хлорида лития и вносят в пламя. Появляется малиновое окрашивание. После обработки в соляной кислоте и прокаливания проволоку, смоченную в растворе хлорида натрия, вносят в пламя. Наблюдают желтое окрашивание. Визуальные наблюдения _______________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________
Опыт 3. Гидролиз солей щелочных металлов. В пробирки внести растворы солей щелочных металлов. Проверьте рН растворов с помощью индикатора. Визуальные наблюдения _______________________________________________ ____________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ Опыт 4. Получение оксида и гидроксида кальция. Пользуясь щипцами, прокалите небольшой кусочек мела на пламени спиртовки в течение нескольких минут. После этого опустите образовавшийся твердый продукт разложения в пробирку с дистиллированной водой. К полученному раствору прибавьте 1 каплю фенолфталеина. Визуальные наблюдения _______________________________________________ ____________________________________________________________________ ____________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ________________________________________________________________________________________________________________________________________
Опыт 5. Получение и свойства гидроксида магния. В пробирку с раствором соли магния прибавьте по каплям раствор щелочи до образования осадка. Полученный осадок разделите на три части и поместите в пробирки. В первую прибавьте по каплям концентрированный раствор щелочи, во вторую — концентрированную соляную кислоту, в третью — насыщенный раствор хлорида аммония NH4C1. Визуальные наблюдения _______________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ Опыт 6. Окрашивание пламени солями щелочноземельных металлов. Платиновую проволочку опустите в насыщенный раствор соли кальция. Извлеченную проволочку внесите в пламя горелки. Повторите опыт с насыщенными растворами солей магния, стронция, бария. Визуальные наблюдения _______________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 7. Гидролиз солей щелочноземельных металлов. В пробирки внести растворы солей щелочноземельных металлов. Проверьте рН растворов с помощью индикатора. Визуальные наблюдения _______________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ Контрольные вопросы к лабораторной работе «ЩЕЛОЧНЫЕ И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ». 1. Щелочные металлы. Электронная структура атомов. 2. Какие, окислительные или восстановительные свойства проявляют щелочные металлы и почему? 3. Щелочные металлы. Распространение в природе. 4. Гидроксиды щелочных металлов. Физические и химические свойства. Применение в технике. 5. Элементы IIА группы. Электронная структура атомов. Как изменяются свойства металлов с увеличением порядкового номера? 6. Щелочноземельные металлы. Распространение в природе. 7. Жесткость воды. Способы устранения карбонатной и некарбонатной жесткости воды. 8. Сколько граммов гидрокарбоната кальция содержится в 2 м3 воды, жесткость которой равна 5 мэкв/л ? 9. Определите временную жесткость воды, если на титрование 0,05 л воды израсходовано 0,003 л 0,1н раствора соляной кислоты. 10. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: MgO → MgSO4 → Mg(OH)2 → MgOHCl → MgCl2 → MgCO3 → MgO 11. Допишите уравнения реакций: K + H2O → ; Na2O + H2O → ; K + Cl2 → ; Mg + H2SO4 (конц.) → ; Mg + H2SO4 (разб.) → ; Mg + HNO3 (конц.) → ; Mg + HNO3 (разб.) → 12. Вычислить, какой объем воды (ρ = 1 г/см3) необходим для гашения 5,6 т извести активностью 90%? 13. Сколько углекислого газа (н.у.) выделится при термическом разложении 150 тонн известняка с содержанием карбоната кальция 98%? 14. Какой объем 1М раствора KOH может быть приготовлен из 2 л 35% раствора (ρ = 1,34 г/см3)? Для заметок_______________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ ЛАБОРАТОРНАЯ РАБОТА №7. МАРГАНЕЦ. ЖЕЛЕЗО
ОПЫТ 1 .Получение и свойства гидроксида марганца (II) В пробирку с раствором соли марганца добавьте раствор гидроксида натрия. Полученный осадок разделите на две части и поместите в пробирки. В первую прибавьте раствор гидроксида натрия, во вторую — раствор соляной кислоты. Визуальные наблюдения _______________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ОПЫТ 2.Окислительные свойства перманганата калия а) Окисление перманганатом калия соли марганца. В пробирку с раствором перманганата калия прибавьте раствор соли марганца (II). Визуальные наблюдения _______________________________________________ ________________________________________________________________________________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________ б) Окисление перманганатом калия пероксида водорода. В пробирку внесите раствор перманганата калия, подкислите 2-3 каплями разбавленной серной кислотой и добавьте раствор пероксида водорода. Определите выделяющийся газ тлеющей лучиной. Визуальные наблюдения _______________________________________________ ____________________________________________________________________ ____________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ в) Восстановление перманганата калия сульфитом натрия(или нитритом натрия) при различных значениях рН среды. В три пробирки внесите по 1 см3 раствора перманганата калия. В первую пробирку добавьте раствор разбавленной серной кислоты, во вторую — воду, в третью — раствор щелочи. Затем в каждую пробирку добавьте раствор восстановителя (Na2S03 или NaNO2). Визуальные наблюдения _______________________________________________ ____________________________________________________________________ ____________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ Опыт 2.Качественные реакция на ионы железа. а) Качественная реакция на ион железа (II). В пробирку налейте раствор соли железа (II), подкислите 2-3 каплями разбавленной серной кислотой и добавьте раствор гексацианоферрата (III) калия до выпадения темно-синего осадка турнбуленовой сини. Полученный осадок разделите на две части и поместите в пробирки. В первую прибавьте раствор гидроксида натрия, во вторую — раствор соляной кислоты. Визуальные наблюдения _______________________________________________ ____________________________________________________________________ ____________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ б) Качественная реакция на ион железа (III). В пробирку налейте раствор соли железа (III), прибавьте столько же разбавленного раствора соляной кислоты и добавьте раствор гексацианоферрата (II) калия до выпадения темно-синего осадка берлинской лазури. Полученный осадок разделите на две части и поместите в пробирки. В первую прибавьте раствор гидроксида натрия, во вторую — избыток гексацианоферрата (II). Визуальные наблюдения _______________________________________________ ____________________________________________________________________ ____________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ Опыт 3.Восстановительные свойства соединений железа (П) а) Восстановление перманганата калия. В пробирку налейте раствор перманганата калия, подкислите 2-3 каплями разбавленной серной кислотой и добавьте раствор соли Мора. В полученном растворе определите наличие ионов Fe3+ качественной реакцией с роданидом калия (или аммония). Визуальные наблюдения _______________________________________________ ____________________________________________________________________ ____________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ б) Восстановление дихромата калия. В пробирку налейте раствор дихромата калия, подкислите 2-3 каплями разбавленной серной кислотой и добавьте раствор соли Мора. В полученном растворе определите наличие ионов Fe3+ качественной реакцией с роданидом калия (или аммония). Визуальные наблюдения _______________________________________________ ____________________________________________________________________ ____________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ Опыт 4.Окислительные свойства соединений железа (Ш). а) Окисление иодида калия. В пробирку с раствором соли железа (Ш) добавьте раствор иодида калия. Визуальные наблюдения _______________________________________________ ____________________________________________________________________ ____________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ б) Окисление цинка. В пробирку с раствором соли железа (Ш) внесите кусочек цинка. Визуальные наблюдения _______________________________________________ ____________________________________________________________________ ____________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ Опыт 5.Получение сульфидов железа. В одну пробирку налейте раствор соли железа (Ш), в другую — такой же объем раствора соли Мора. В пробирки добавьте раствор сульфида аммония до выпадения осадка. Визуальные наблюдения _______________________________________________ ____________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ Опыт 6.Гидролиз солей железа. а) Гидролиз сульфата железа (II). В пробирку внесите соль Мора, добавьте дистиллированную воду и взболтайте. Установите реакцию среды в полученном растворе. Визуальные наблюдения _______________________________________________ ____________________________________________________________________ ____________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ б) Гидролиз хлорида железа (III). В пробирку внесите хлорид железа (Ш), добавьте дистиллированную воду и взболтайте. Установите реакцию среды в полученном растворе. Визуальные наблюдения _______________________________________________ ____________________________________________________________________ ____________________________________________________________________ Уравнение реакций ___________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________
Контрольные вопросы к лабораторной работе «МАРГАНЕЦ. ЖЕЛЕЗО». 1. Марганец. Электронная структура атома. Степени окисления. 2. Марганец. Распространение в природе. Основные минералы. 3. Оксиды марганца. Структура, химические свойства. 4. Окислительные свойства перманганата калия в зависимости от рН среды. 5. Железо. Электронная структура атома. Степени окисления. 6. Железо. Распространение в природе. Железные руды. 7. Производство чугуна и стали. Сплавы железа. 8. Оксиды и гидроксиды железа, химические свойства. 9. Укажите качественные реакции на присутствие в растворе солей двухвалентного и трехвалентного железа. 10. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe2 (SO4)3 → Fe2O3 11. Методом электронного баланса расставьте коэффициенты и закончите составление уравнений окислительно-восстановительных реакций: KMnO4 + K2SO3 + H2SO4 → MnSO4 + K2SO4 + ….. KMnO4 + K2SO3 + H2O → MnO2 + K2SO4 + ….. KMnO4 + K2SO3 + KOH → K2MnO4 + K2SO4 + ….. 12. Какая масса гидроксида железа (II) вступает в реакцию с гидроксидом аммония в нейтральной среде, если объем выделившегося аммиака (н.у.) равен 1,12 л? 13. Какой объем кислорода (н.у.) выделится при термическом разложении 10 г перманганата калия? 14. Какую массу кристаллогидрата Fe2 (SO4)3 • 9H2O необходимо взять для приготовления 200 г 15% раствора сульфата железа (III)? Для заметок_______________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА:
1.Глинка Н.Л Общая химия: Учебное пособие для вузов / Н.Л.Глинка; Под ред. В.А. Рабиновича. - 22-е изд., испр. - Л.: Химия, 1982. – 720 с. 2. Карапетьянц М.Х. Общая и неорганическая химия / М.Х.Карапепетьянц, С.И.Дракин. – М.:Химия, 1993. – 592 с. 3. Ахметов.Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М.: Высшая школа, 2001. – 743 с. 4. Балятинская Л.Н. Методические указания к выполнению лабораторного практикума по дисциплине «Неорганическая химия». Ч.2. Химия элементов и их соединений / Л.Н. Балятинская, И.П. Лукина, В.И. Дейнека и др. – Белгород: Изд-во БелГУ, 2007. – 108 с. 5. Клименко В.Г. Химия элементов: Задание по самоподготовке для студентов… / В.Г. Клименко, А.Н. Володченко. – Белгород, Изд-во БелГТАСМ, 1999. – 87 с. 6. Бабич Л.В. Практикум по неорганической химии: Учебное пособие для студентов пед. ин-тов / Л.В. Бабич, С.А.Балезин, Ф.Б. Гликина и др. - 4-е изд. перераб. - М.: Просвещение, 1991. – 320 с.
|