 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Приклади розв’язання типових задач
Приклад 1.Як протікає корозія мангану, що знаходиться у контакті з міддю у кислім середовищі (HCl)? Складіть рівняння анодного та катодного процесів. Дайте схему утвореного при цьому гальванічного елемента. Розв’язання. За величиною стандартного електродного потенціалу φ
Анодний процес: Катодний процес:
Схема гальванічного елемента:
Приклад 2. Визначте, які корозійні процеси протікають у нейтральному середовищі при ушкодженні срібного покриття, нанесеного на залізо. Розв’язання. У місці ушкодження срібного покриття утворюється гальванічна пара срібло – залізо, у якій анодом буде залізо (φ
А(–) 2 К(+)
2Fe + O2 + 2H2O = 2Fe(OH)2.
Утворений нерозчинений гідроксид Fe(OH)2 згодом окиснюється до Fe(OH)3:
Приклад 3. При порушенні поверхневого шару мідного покриття на цинку протікає корозія внаслідок роботи гальванопари
За 35 с роботи гальванопари на катоді виділилося 0,07 л водню (н. у.). Розв’язання. Максимальна сила струму, яку може дати гальванічний елемент, визначається співвідношенням:
I = m F/Meк ,
де I – сила струму; m – маса розчиненого за секунду металу на аноді або речовини, що виділилася на катоді, г; F – стала Фарадея, Кл/моль; Мек – молярна маса еквівалента металу, з якого виготовлено анод, або молярна маса еквівалента елемента, що виділився на катоді, г/моль. За секунду на катоді виділяється 0,07 : 35 = 0,002 л водню. Відомо, що де Гальванічний елемент дає струм
I = 0,002 × 96500/11,2 = 17,2 А.
Молярна маса еквівалента цинку дорівнює 32,7 г/моль. Визначаємо скільки цинку розчинилося за 35 с роботи гальванопари
Питання для самоперевірки 1. У чому суть хімічної та електрохімічної корозії металів? 2. Що таке воднева і киснева деполяризації? 3. Які фактори впливають на швидкість корозії? 4. Для яких металів може становити небезпеку лужне середовище? 5. Як здійснюється захист металів від корозії? Наведіть приклади електрохімічного захисту від корозії металів у промисловості. 6. Чим відрізняються анодні та катодні металеві покриття? Які процеси відбуваються при порушенні цих покриттів у кислому середовищі? Контрольні завдання 15.1. Як відбувається атмосферна корозія лудженого й оцинкованого заліза при порушенні покриття? Складіть рівняння катодного та анодного процесів. 15.2. Мідь не витискує водень із розведених кислот. Чому? Однак, якщо до мідної пластинки, зануреної у розчин кислоти, доторкнутися цинковою, на міді почнеться бурхливе виділення водню. Поясніть це явище, склавши рівняння анодного й катодного процесів. Напишіть рівняння хімічної реакції, що протікає при цьому. 15.3. Залізний виріб покрили нікелем. Яке це покриття – анодне чи катодне? Чому? Складіть електродні рівняння анодного та катодного процесів корозії цього виробу при порушенні покриття у вологому повітрі й у хлоридній кислоті. Які продукти корозії утворюються у першому і другому випадках? 15.4 Складіть електронні рівняння анодного й катодного процесів з кисневою та водневою деполяризацією при корозії пари металів магній-нікель. Які продукти корозії утворюються у першому і другому випадках? 15.5. Чому хімічно чисте залізо більш стійке до корозії, ніж технічне? Складіть електронні рівняння анодного й катодного процесів, які проходять при корозії технічного заліза у вологому повітрі й у кислому середовищі. 15.6. Залізний виріб покрили кадмієм. Яке це покриття – анодне чи катодне? Чому? Складіть електронні рівняння анодного й катодного процесів корозії цього виробу при порушенні покриття у вологому повітрі й хлоридній кислоті. Які продукти корозії утворюються в кожному випадку?
|



 = – 1,18 В , φ
= – 1,18 В , φ  = 0,34 В знаходимо, що в утвореній гальванічній парі манган буде анодом, а мідь – катодом.
= 0,34 В знаходимо, що в утвореній гальванічній парі манган буде анодом, а мідь – катодом. – 2ē =
– 2ē =  .
. + 2ē =
+ 2ē =  .
. .
. = –0,44 В) а катодом – срібло (φ
= –0,44 В) а катодом – срібло (φ  При цьому на аноді розчиняється залізо, а на катоді відновлюється кисень:
При цьому на аноді розчиняється залізо, а на катоді відновлюється кисень: – 4ē = 2
– 4ē = 2 
 + 4ē =
+ 4ē = 

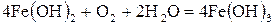 .
.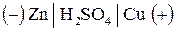 .
.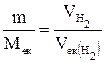 ,
, – об’єм водню, що виділився за секунду на катоді, л;
– об’єм водню, що виділився за секунду на катоді, л;  – молярний об’єм еквівалента водню, л/моль.
– молярний об’єм еквівалента водню, л/моль. .
.