 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Фактори, що впливають на швидкість корозії
Швидкість корозії може характеризуватися одним з таких способів: – втратою маси металу за одиницю часу з одиниці площі; – зменшенням товщини металу за одиницю часу; – силою корозійного струму, яка віднесена до одиниці поверхні металу. На швидкість корозії впливають сім факторів: 1. Чистота металу. Чим чистіший метал, тим менше на його поверхні мікрогальванічних елементів і тим повільніше йде корозія. 2. Взаємне розташування металів, які складають корозійний елемент, в ряду електрохімічних потенціалів. Чим далі в ряду електрохімічних потенціалів знаходяться один від одного метали, з яких утворюється корозійний елемент, тим швидкість корозії більша. 3. Стан поверхні металу. Гладкі поверхні корозують повільніше, ніж шорсткі, оскільки іони металу, що знаходяться на виступних частинах шорсткої поверхні, не так міцно з’єднані з основною масою металу і корозія починається на цих виступах. 4. рН середовища. Відносно рН середовища спостерігаються два випадки: а) при корозії металів, гідроксиди яких є основами, інтенсивність корозії зменшується із збільшенням рН середовища. Це пов’язано з тим, що на катоді відбувається процес кисневої деполяризації:
К (+) 2Н 2О + О2 + 4ē = 4ОН¯,
при якому утворюються іони ОН¯ і згідно з принципом Ле-Шательє процес корозії зменшується в лужному середовищі ( рН > 7 ); б) при корозії металів, гідроксиди яких мають амфотерні властивості, інтенсивність корозії найповільніша в нейтральному середовищі, особливо збільшується в лужному (рН = 8 – 10) та кислому (рН < 2). 5. Концентрація кисню. Залежність швидкості корозії від концентрації О2 складна. Кисень у корозійних процесах виконує дві найважливіші функції: – деполяризатор; – пасиватор. Пасиватори– це речовини, які окиснюють метал на поверхні, при цьому утворюється міцна плівка оксиду металу, яка захищає його від подальшої корозії. При зростанні концентрації кисню збільшується швидкість корозії. При подальшому збільшенні цієї концентрації поверхня металу насичується киснем і відбувається процес пасивації, при цьому швидкість корозії стає повільнішою. 6. Вологість. При атмосферній корозії зі збільшенням вологості При ґрунтовій корозії збільшення вологості спричиняє спочатку збільшення швидкості корозії, а потім зниження її, що починається в той момент, коли пори в ґрунті заповнюються водою – це перешкоджає доступу кисню до поверхні металу. 7. Гази в повітрі й домішки у воді. Гази, що викидаються промисловими підприємствами (NхOу, сполуки S, Cl2, CO2 та ін.), прискорюють корозію металу. В непромисловій місцевості корозія проходить повільніше. Багато домішок у природній воді прискорюють корозію металевих споруд, що знаходяться під водою, особливо шкідливі речовини, що сприяють розчиненню оксидної плівки. Ці речовини називаються активаторами або стимуляторами. Прикладом таких речовин є іони хлору (Cl¯). Методи захисту металу від корозії
Для захисту металу від корозії застосовується багато різних методів, але немає єдиної класифікації, тому використовуємо одну з найбільш зручних, у якій всі методи поділені на чотири групи: захисні покриття; зміна складу металу; зміна складу середовища; електрохімічний захист. Захисні покриття
Захисні покриття поділяють на три типи: неметалеві, металеві та хімічні. Неметалеві покриття – це покриття, які наносяться лаком, полімерними плівками, асфальтом, гумою та ін. Металеві покриття – це шар стійкого до корозії металу, який знаходиться на поверхні основного металу і захищає його від корозії. Способи нанесення захисного металу на поверхню основного: – гальванопокриття (за допомогою електролізу); – розпилення розплавленого захисного металу по поверхні основного; – занурювання основного металу в розплавлений захисний метал; – сукупний прокат двох металів.
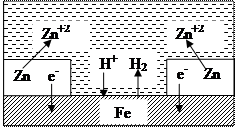
1) анодне (метал захисту більш негативний, рис. 35):
A(–) Zn – 2ē = Zn2+ – корозія, K(+) 2Н+ + 2ē = Н2 – воднева деполяризація; Рис. 35. Анодне покриття 2)
позитивний, рис. 36):
K(+) Sn H2SO4 Fe A(–) A(–) Fe – 2ē = Fe2+ – корозія, K(+) 2Н+ + 2ē = Н2 – воднева деполяризація. Рис. 36. Катодне покриття
Анодні покриття на відміну від катодних після появи тріщин продовжують захищати метал від корозії. Хімічними є покриття, що утворюються на поверхні металу при обробці її різними хімічними реагентами. Це процеси: фосфатування, оксидування, борування, азотування та ін. Наприклад, при фосфатуванні поверхню металу обробляють сумішшю мажеф (Mn(H2PO4)2, Fe(H2PO4)2). При взаємодії цієї суміші з поверхнею утворюється густа міцна плівка сполуки фосфору, яка надійно захищає метал від корозії. При оксидуванні на поверхні металу також утворюється міцна плівка оксиду, яка виконує захисну функцію.
Зміна складу металу Зміну складу металу з метою запобігання від корозії можна здійснювати в трьох напрямках: – очищення металу; – антикорозійні добавки, наприклад, індій додають у невеликій кількості в сплави кольорових металів. При цьому підвищується корозійна стійкість металу; талій у сплавах оберігає метал від корозії в кислому середовищі; – створення сплавів, стійких до корозії (нержавіюча сталь – 12% Cr,
Зміна складу середовища
До змін середовища відносять: – видалення з розчинів шкідливих домішок; – регулювання рН; – використання інгібіторів корозії. Інгібітори – це речовини, що уповільнюють швидкість корозії. Анодні інгібітори – це речовини, що пасивують анод (створюють оксидні плівки на аноді). Катодні інгібітори – це сполуки, що адсорбуються на поверхні катода і уповільнюють процес деполяризації. Екрануючі інгібітори – це такі, що збираються навколо поверхні металу і уповільнюють процеси на електродах. Леткіінгібітори використовуються для перевезення металевих конструкцій, ними заповнюється простір контейнера, і корозія металу йде повільніше.
Електрохімічний захист
Існують протекторний і катоднийелектрохімічні захисти, які застосовуються тільки в середовищах, що проводять електричний струм.
Протекторний захист
A(–) Zn Н2О, O2 Fe K(+)
K(+) 2H2O + O2 + 4ē = 4OH¯
Zn 2Zn + 2H2O + O2 = 2Zn2+ + 4OH¯ 2Zn + 2H2O + O2 = 2 Zn(OH)2 Рис. 37. Схема протекторного захисту Розчиняється більш активний метал – протектор, а на поверхні основного відбувається процес деполяризації. Термін роботи протектора в ґрунті близько 10 років. Радіус дії протекторного захисту до 50 м.
Для нього використовуються джерела постійного струму. Постійний струм підводять до металевої конструкції (труби) так, щоб вона була катодом, до анода приєднується рейка (рис. 38. Відбувається процес електролізу з розчинним анодом. Руйнується металобрухт, але конструкція не страждає від корозії. Радіус катодного захисту до 2 км. Рейка Труба
Рис. 38. Схема катодного захисту |



 Металеві покриття поділяють на два типи:
Металеві покриття поділяють на два типи:

 A(–) Zn H2SO4 Fe K(+)
A(–) Zn H2SO4 Fe K(+)


 До металоконструкції на певній відстані приєднують пластину більш активного металу (Zn, Mg) (рис. 37). При цьому утворюється гальванічний елемент, схема якого має вигляд:
До металоконструкції на певній відстані приєднують пластину більш активного металу (Zn, Mg) (рис. 37). При цьому утворюється гальванічний елемент, схема якого має вигляд:


 Катодний захист
Катодний захист