 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Властивості свинцю та його сполук
Свинець Рb – метал синьовато-білого кольору, легкоплавкий (tпл =327,40С), м’який, дуже пластичний, не достатньо міцний, легко кується. Свинець – важкий метал, його густина 11340 кг/м3. На повітрі він тьмяніє, покриваючись оксидною плівкою РbО, а в присутності вологи взаємодіє з киснем повітря:
2Рb + О2 + 2Н2О = 2Рb(ОН)2. За високих температур свинець взаємодіє з багатьма неметалами, утворюючи сполуки зі ступенем окиснення +2. Складіть рівняння хімічних реакцій взаємодії свинцю з неметалами-окисниками. Від’ємний ступінь окиснення Плюмбум проявляє тільки при взаємодії з електропозитивними елементами: 2Мg + Рb = Мg2Рb (магній плюмбид). З воднем безпосередньо свинець не реагує, але непрямим шляхом він утворює нестійкий, дуже отруйний газ плюмбан РbН4. Свинець практично не розчиняється в розбавлених хлоридній і сульфатній кислотах, швидко покриваючись плівками малорозчинних солей. Тільки при дії концентрованої сульфатної кислоти утворюється розчинна кисла сіль Рb(НSO4)2, і свинець починає розчинятись. На відміну від олова, свинець проявляє себе як метал і при взаємодії з розбавленою та концентрованою нітратною кислотою, утворюючи сіль плюмбум (ІІ) нітрат: Рb + 4НNO3(конц.) = Рb(NO3)2 + 2NO2 + 2Н2О. При нагріванні свинцю на повітрі утворюється плюмбум (ІІ) оксид РbО. За наявності великої кількості кисню і не дуже високої температури він поступово переходить у оксид Рb3О4 (сурик). РbО – жовтого кольору, РbО2 – темно-коричневого, а Рb3О4 – яскраво-червоного. Для Плюмбуму більш характерні сполуки з ступенем окиснення +2. Так при дії на плюмбум (ІІ) оксид хлоридної кислоти спочатку утворюється плюмбуму (ІV) хлорид, який легко відщеплює хлор, переходячи в плюмбум (ІІ) хлорид: РbО2 + 4НCl ⇄ РbCl4 + 2Н2О; РbCl4 ⇄ РbCl2 + Cl2. Окислення сполук плюмбуму (ІІ) до плюмбуму (ІV) відбувається тільки з застосуванням сильних окисників: Рb(СН3СОО)2 + СаОCl2 + Н2О = РbО2 + 2СН3СООН + СаCl2. Сполуки Плюмбуму (ІV) являються сильними окисниками. Наприклад, при кип’ятінні з 30% сульфатною кислотою плюмбум (ІІ) оксид окиснює Манган (ІІ) до Мангана (VІІ): 5РbО2 + 2MnSO4 + 3H2SO4 = 5РbSO4 + 2HMnO4 + 2Н2О. Свинець входить до складу багатьох сплавів. Його застосовують для виготовлення пуль та дробу. Свинець сильно поглинає гамма-проміні, і тому його використовують для захисту від гамма-випромінення в роботі з радіоактивними речовинами. Плюмбум (ІІ) оксид використовують при виготовленні скла, а саме, кришталю, плюмбуму (ІV) оксид – в кислотних акумуляторах. Плюмбум (ІІ) ацетат Рb(СН3СОО)2 використовують при фарбуванні тканин, а плюмбум (ІІ) хромат РbСrО4 – для виготовлення жовтої фарби. Для узагальнення знань з властивостей розглянутих р-елементів ІІІ та ІV груп ПС та їх сполук складемо таблицю. Таблиця 13.1 Узагальнення властивостей р-елементів ІІІ та ІV груп ПС
Проаналізуйте дану таблицю. Поясніть зміну властивостей хімічних елементів Al, Sn, Pb та їх сполук за положенням в періодичній системі Д.І. Менделєєва. 2. Запитання для самоконтролю і контролю знань 1. В чому полягають особливості будови атомів р-елементів? 2. Які ступені окиснення в сполуках проявляють р-елементи ІІІ та ІV груп ПС? Чому? 3. У вигляді яких мінералів Алюміній, Станум, Плюмбум знаходяться в природі? 4. На прикладах простих речовин металів, які утворюють дані хімічні елементи, поясніть явище алотропії. 5. Порівняйте фізичні властивості даних металів. 6. Складіть рівняння хімічних реакцій, які підтверджують хімічні властивості алюмінію, олова, свинцю. 7. Поясніть характер оксидів та гідроксидів даних металів. Доведіть це за допомогою рівнянь хімічних реакцій. 8. Поясніть окисно-відновні властивості сполук даних металів. Доведіть це за допомогою рівнянь хімічних реакцій. 9. Як хімічним способом довести наявність амфотерних властивостей сполук даних металів? 10. Як застосовуються дані метали та їх сполуки в промисловості? Які сплави з них виготовляють? 3. Приклади розв’язання задач для самостійної роботи 1. Який об’єм одномолярного розчину натрій гідроксиду необхідно взяти, щоб розчинити 5 г сусального золота? Реакція проходить за рівнянням: SnS2 + 6NaОН = Na2[Sn(OH)6] + 2Na2S. Розрахуємо кількість речовини ν SnS2:
За рівнянням реакції: ν(NaОН) = ν(SnS2)∙6 = 0,03∙6 = 0,18 моль. Об’єм одномолярного розчину натрій гідроксиду обчислимо за формулою:
2. При спалюванні 4 г сплаву сульфідів алюмінію та заліза утворилось 3,904 г рідкого сульфур (IV) оксиду. Визначте масові частки обох речовин в сплаві. Реакції горіння сульфідів алюмінію та заліза проходять за рівняннями реакцій: 2Al2S3 + 9O2 = 2Al2O3 + 6SO2↑; 2FeS + 7O2 = 2Fe2O3 + 4SO2↑. Якщо масу алюміній сульфіду в сплаві позначити через х, то маса ферум (ІІ) сульфіду буде (4 - х) г. Для складання алгебраїчного рівняння використаємо схеми з урахуванням молярних мас речовин: х г Al2S3 ⟶ 3SO2 ; 150 г 3∙64 г (4 - х) г FeS ⟶ SO2 . Всього в результаті реакції отримали 3,904 г SO2, тому:
88х + 50(4-х) = 0,061∙50 ∙ 88; х = 1,8 г; m(Al2S3) = 1,8 г.
m(FeS) = 4 – 1,8 = 2,2 г;
ω%(FeS) = 100% - 45% = 55%.
3. До 200 мл одномолярного розчину алюміній сульфату додали 300 мл розчину калій гідроксиду концентрацією 7 моль/л. Визначте масу осаду та молярну концентрацію розчинів солей, які утворились. Реакції в даних розчинах відбуваються за рівняннями: Al2(SO4)3 + 6КОН = 2Al(ОН)3 + 3К2SO4 (1) Al(ОН)3 + 3КOH = К3[Al(OH)6]. (2) Розрахуємо кількість речовин Al2(SO4)3 та КОН в розчинах за формулою: υ = См ∙ Vр; υ (Al2(SO4)3) = 0,2 ∙1 = 0,2 моль; υ (КOH) = 0,3 ∙7 = 2,1 моль. За рівнянням реакції речовини Al2(SO4)3 та КOH знаходяться в співвідношеннях 1:6. Розрахунок кількості речовин за умовою задачі показує, що КОН знаходиться в надлишку (0,2 ∙ 6 = 1,2 ˂ 2,1), тому в розчині утворюється дві солі: К2SO4 та К3[Al(OH)6]. Розрахуємо масу осаду Al(ОН)3, який утворився. За рівнянням реакції (1): υ (Al(ОН)3) = υ(Al2(SO4)3) ∙ 2 = 0,2 ∙ 2 = 0,4 моль; m(Al(ОН)3) = 0,4 ∙ М(Al(ОН)3) = 0,4 ∙78 = 31,2 г. Розрахуємо молярну концентрацію утвореного розчину: а) за К2SO4. За рівнянням реакції (1): υ(К2SO4) = υ(Al2(SO4)3) ∙ 3 = 0,2 ∙ 3 = 0,6 моль. Vрозчину = 200 мл + 300 мл = 500 мл. Тоді См(К2SO4) = б) за К3[Al(OH)6]. Залишилось КОН: 2,1 – (0,2 ∙ 6) = 0,9 моль. За рівнянням реакції (2): υ(К3[Al(OH)6]) = Тоді См(К3[Al(OH)6]) = Завдання для самоконтролю Рівень А 1. Яка кількість речовини алюміній оксиду утвориться при взаємодії 108 г алюмінію з 160 г ферум (ІІІ) оксиду? 2. Яка маса осаду утвориться при взаємодії станум (ІІ) хлориду з 200 мл одномолярного розчину калій гідроксиду? 3. Який об’єм розчину сульфатної кислоти концентрацією 0,1 моль/л необхідно взяти, щоб розчинити 0,2 моль алюміній гідроксиду? Рівень В 1. Визначте процентний склад суміші, яка утвориться при взаємодії 2,7 г алюмінію з 6,4 г ферум (ІІІ) оксиду. 2. При розчиненні 3 г сплаву магнію з алюмінієм в сульфатній кислоті утворилось 16,44 г безводних сульфатів магнію та алюмінію. Визначте процентний склад сплаву. 3. До 300 мл одномолярного розчину станум (ІV) хлориду додали 500 мл розчину натрій гідроксиду концентрацією 5 моль/л. Визначте масу осаду та молярну концентрацію розчину солей, які утворились. Рівень С 1. При розчиненні 10 г сплаву міді, заліза та алюмінію в хлоридній кислоті утворилось 5,04 л (н.у.) водню і 3,1 г нерозчиненого осаду. Визначте процентний склад сплаву. 2. До розчину, який містить 16 г ферум (ІІІ) сульфату та 27,36 г алюміній сульфату, додали розчин, який містить 33,6 г натрій гідроксиду. Осад відфільтрували та прожарили, а фільтрат розчинили до 500 мл. Визначте масу і склад прожареного осаду та молярну концентрацію розчинів солей, які утворились. 3. До розчину, який містить 11,9 г аргентум нітрату, додали розчин, який містить 2,67 г алюміній хлориду. Осад відфільтрували, а фільтрат випарили. Визначити кількість утвореного аргентум хлориду, масу і склад залишку після випаровування фільтрату, якщо утворюється кристалогідрат алюміній нітрату Al(NO)3 ∙ 9H2O. Експериментальна частина Дослід 1. Взаємодія алюмінію з кислотами. Рівень А В три пробірки внесіть по 2-3 мл одномолярних розчинів кислот: хлоридної, сульфатної, нітратної. В кожну з пробірок опустіть по шматочку алюмінієвої фольги. Хімічним способом доведіть наявність водню, який виділяється при взаємодії алюмінію з розчинами хлоридної та сульфатної кислот. Спостерігайте виділення бурого газу при взаємодії алюмінію з розчином нітратної кислоти. Складіть рівняння окисно-відновних реакцій та рівняння електронного балансу. Запишіть спостереження та висновки. Рівень В В три пробірки внесіть по 2-3 мл розчинів концентрованих кислот: хлоридної, сульфатної, нітратної. В кожну з пробірок опустіть по шматочку алюмінієвої фольги. Спостерігайте проходження хімічних реакцій за кімнатних умов та при нагріванні. Спостерігайте утворення газів та інших речовин в кожній з пробірок за різних умов та поясніть різницю в проходженні хімічних процесів. Складіть рівняння окисно-відновних реакцій та рівняння електронного балансу. Запишіть спостереження та висновки. Рівень С Теоретично обґрунтуйте взаємодію алюмінію з хлоридної, сульфатною та нітратною кислотами в залежності від їх концентрації та умов протікання (за кімнатних умов, при нагріванні). В пробірку з розчином хлоридної кислоти опустіть стрічку алюмінієвої фольги до виділення газу. Хімічним способом доведіть, який газ виділився. Заберіть алюміній з пробірки, промийте водою, опустіть в розчин концентрованої нітратної кислоти (ρ = 1,4 г/мл) на 2-3 хв. Висуньте, промийте водою та знову опустіть в пробірку з хлоридної кислотою. Запишіть спостереження. Поясніть процеси, які відбулись з металом на всіх етапах дослідження. Поясніть процес пасивації алюмінію. Зробіть та запишіть висновки. Дослід 2. Взаємодія алюмінію з розчином лугу. Рівень А Внесіть в пробірку шматочки алюмінієвої фольги, додайте розчин лугу, нагрійте. Хімічним способом доведіть наявність виділеного водню. Складіть рівняння окисно-відновної реакції та рівняння електронного балансу. Запишіть спостереження та висновки. Рівень В Внесіть в пробірку шматочки алюмінієвої фольги, додайте дистильованої води, нагрійте пробірку. Запишіть спостереження. Додайте в пробірку декілька крапель одномолярного розчину лугу. Запишіть спостереження. Поясніть різницю в проходження хімічних процесів. Складіть рівняння хімічної реакції, проаналізуйте процес як окисно-відновний. Рівень С Теоретично обґрунтуйте можливість проходження хімічних реакцій взаємодії алюмінію з водою та розчином лугу. Стрічку алюмінію зачистіть наждачним папером, промийте водою, висушіть фільтрувальним папером і опустіть в пробірку з дистильованою водою. Запишіть спостереження. Додайте в пробірку декілька крапель одномолярного розчину лугу. Запишіть спостереження. На інший шматочок алюмінію нанесіть декілька крапель розчину Hg2(NO3)2. Висушіть алюміній і знов опустіть в пробірку з дистильованою водою. Запишіть спостереження. Поясніть проходження процесів в першому і другому випадках. Складіть рівняння хімічних реакцій. Зробіть висновки. Дослід 3. Взаємодія олова з кислотами. Рівень А В три пробірки покладіть по маленькому шматочку металічного олова. В кожну з пробірок додайте декілька крапель розчинів кислот: хлоридної, сульфатної, нітратної. Спостерігайте повільну взаємодію металів з кислотами за кімнатних умов. Нагрійте пробірки в невеличкому полум’ї пальника. Хімічним способом доведіть наявність водню в пробірках з хлоридною та сульфатною кислотами. Спостерігайте виділення бурого газу в пробірці з нітратною кислотою. Запишіть спостереження. Складіть рівняння хімічних реакцій з урахуванням того, що олово окислюється розбавленими кислотами до Sn2+ з утворенням відповідних солей, а з НNО3 виділяється переважно нітроген (ІІ) оксид. Зробіть висновки. Рівень В В три пробірки покладіть по маленькому шматочку металічного олова. В кожну з пробірок додайте декілька крапель концентрованих кислот: хлоридної, сульфатної, нітратної. Проведіть реакції за кімнатних умов та при нагріванні. Порівняйте проходження процесів в пробірках. Хімічним способом доведіть наявність газу в пробірці з хлоридної кислотою. За запахом визначте наявність газу в пробірці з сульфатною кислотою. Складіть рівняння хімічних реакцій з урахуванням того, що олово окислюється до Sn4+. Поясніть різницю у взаємодії олова з розбавленою та концентрованою нітратною кислотою. Запишіть спостереження. Зробіть висновки. Рівень С Теоретично обґрунтуйте та експериментально доведіть різницю у взаємодії алюмінію та олова з розбавленими та концентрованими хлоридною, сульфатною, нітратною кислотами. Узагальніть спостереження. Зробіть висновки. . Складіть рівняння хімічних реакцій. Дослід 4. Дослідженя властивостей сполук олова. Рівень А В дві пробірки внесіть по 2-3 мл розчину станум (ІІ) хлориду. В кожну пробірку додайте по декілька крапель розчину лугу до утворення осаду. Яка речовина утворилась? В першу пробірку додайте декілька крапель хлоридної кислоти, а в другу – розчину лугу до розчинення осаду. Складіть рівняння хімічних реакцій. Запишіть спостереження. Зробіть висновки. Рівень В Налийте в пробірку дистильованої води, опустіть по декілька кришталиків станум (ІІ) хлориду. Розмішайте реактив до повного розчинення. Складіть іонне та молекулярне рівняння гідролізу. До отриманого розчину додайте іще декілька крапель води. Поясніть утворення осаду в пробірці. Додаванням якого реактиву можна зменшити гідроліз даної солі? Доведіть свої припущення експериментально. Запишіть спостереження. Зробіть висновки. Рівень С Теоретично обґрунтуйте та експериментально доведіть наявність відновлювальних властивостей сполук стануму (ІІ) на прикладі взаємодії стануму (ІІ) хлориду з калій перманганатом та калій біхроматом в кислому середовищі. Складіть рівняння відповідних реакцій. Запишіть спостереження. Зробіть висновки.
|



 - s2p1
- s2p1

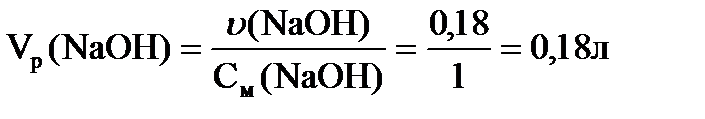 .
. ;
; ;
; ;
; моль/л.
моль/л. моль.
моль. моль.
моль.