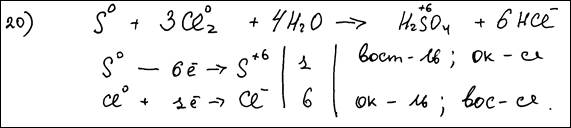ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение
Как определить диапазон голоса - ваш вокал
Игровые автоматы с быстрым выводом
Как цель узнает о ваших желаниях прежде, чем вы начнете действовать. Как компании прогнозируют привычки и манипулируют ими
Целительная привычка
Как самому избавиться от обидчивости
Противоречивые взгляды на качества, присущие мужчинам
Тренинг уверенности в себе
Вкуснейший "Салат из свеклы с чесноком"
Натюрморт и его изобразительные возможности
Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д.
Как научиться брать на себя ответственность
Зачем нужны границы в отношениях с детьми?
Световозвращающие элементы на детской одежде
Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия
Как слышать голос Бога
Классификация ожирения по ИМТ (ВОЗ)
Глава 3. Завет мужчины с женщиной

Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
 Отёска стен и прирубка косяков - Когда на доме не достаёт окон и дверей, красивое высокое крыльцо ещё только в воображении, приходится подниматься с улицы в дом по трапу. Отёска стен и прирубка косяков - Когда на доме не достаёт окон и дверей, красивое высокое крыльцо ещё только в воображении, приходится подниматься с улицы в дом по трапу.
 Дифференциальные уравнения второго порядка (модель рынка с прогнозируемыми ценами) - В простых моделях рынка спрос и предложение обычно полагают зависящими только от текущей цены на товар. Дифференциальные уравнения второго порядка (модель рынка с прогнозируемыми ценами) - В простых моделях рынка спрос и предложение обычно полагают зависящими только от текущей цены на товар.
| Материалы для практических занятий экспертов
4.1. Материалы для практических занятий по оценке выполнения заданий разных типов (по линиям заданий) Задание 20(С1) Используя метод электронного баланса, составьте уравнение реакции S + Cl2 + H2O → H2SO4 + HCl Определите окислитель и восстановитель. | Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы | Элементы ответа: 1) Составлен электронный баланс: | Cl20 + 2ē → 2Cl-1 S0 – 6ē → S+6 | 2) Указано, что сера в степени окисления 0 является восстановителем, а хлор в степени окисления 0 (или Cl2) – окислителем; 3) Составлено уравнение реакции: S + 3Cl2 + 4H2O = H2SO4 + 6HCl | | | Ответ правильный и полный, содержит все названные выше элементы | | | В ответе допущена ошибка только в одном из элементов | | | В ответе допущены ошибки в двух элементах | | | Все элементы ответа записаны неверно | | | Максимальный балл | 3 | С1) 
С1) 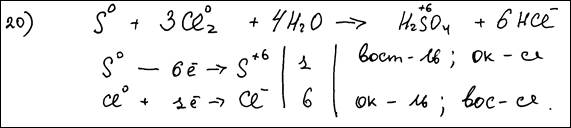
С1) 
С1) 
С1) 
Задание 21(С2) 1 – 21 (С2) А. К 104 г раствора с массовой долей хлорида бария 9% добавили избыток раствора фосфорной кислоты. Вычислите массу образовавшегося осадка. | Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) | | 1) Составлено уравнение реакции: 3BaCl2 + 2H3PO4 = Ba3(PO4)2 + 6HCl 2) Рассчитана масса и количество вещества хлорида бария, содержащегося в растворе: m (BaCl2) = m(p-pа) ∙ ω/100 = 104 ∙ 0,09 = 9,36 г n (BaCl2) = m (BaCl2)/ M (BaCl2) = 9,36 : 208 = 0,045 моль 3) Определена масса образовавшегося осадка: по уравнению реакции n (Ba3(PO4)2) = 1/3n (BaCl2) = 0,015 моль m (Ba3(PO4)2) = n (Ba3(PO4)2) ∙ M(Ba3(PO4)2) = 0,015 ∙ 602 = 9,03г | | | Критерии оценивания | Баллы | | Ответ правильный и полный, включает все названные элементы. | | | Правильно записаны 1-й и 2-й элементы из названных выше. | | | Правильно записан один из названных выше элементов (1‑й или 2‑й). | | | Все элементы ответа записаны неверно. | | | Максимальный балл | | С2) - 1А 
С2) - 2А 
С2) - 3А 
4 – 21 (С2) Б.К 296 г раствора с массовой долей нитрата магния 6% добавили избыток раствора фосфорной кислоты. Вычислите массу образовавшегося осадка. | Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) | | 1) Составлено уравнение реакции: 3Mg(NO3)2 + 2H3PO4 = Mg3(PO4)2 + 6HNO3 2) Рассчитана масса и количество вещества нитрата магния, содержащегося в растворе: m (Mg(NO3)2) = m(p-pа) ∙ ω/100 = 296 ∙ 0,06 = 17,76 г n (Mg(NO3)2) = m (Mg(NO3)2)/ M (Mg(NO3)2) = 17,76 : 148 = 0,12 моль 3) Определена масса образовавшегося осадка: по уравнению реакции n (Mg3(PO4)2) = 1/3n (Mg(NO3)2) = 0,04 моль m (Mg3(PO4)2) = n (Mg3(PO4)2) ∙ M(Mg3(PO4)2) = 0,04 ∙ 263 = 10,52г | | | Критерии оценивания | Баллы | | Ответ правильный и полный, включает все названные элементы. | | | Правильно записаны 1-й и 2-й элементы из названных выше. | | | Правильно записан один из названных выше элементов (1‑й или 2‑й). | | | Все элементы ответа записаны неверно. | | | Максимальный балл | | С2) - 4Б 
5 – 21 (С2) - В. К раствору сульфита натрия массой 252 г и массовой долей 5% добавили избыток раствора соляной кислоты. Вычислите объем (н.у.) выделившегося газа. | Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) | | 1) Составлено уравнение реакции: Na2SO3 + 2HCl = 2NaCl + SO2 + H2O 2) Рассчитана масса и количество вещества сульфита натрия, содержащегося в растворе: m (Na2SO3) = m(p-pа) ∙ ω/100 = 252 ∙ 0,05 = 12,6 г n (Na2SO3) = m (Na2SO3)/ M (Na2SO3) = 12,6 : 126 = 0,1 моль 3) Определен объем газообразного вещества, вступившего в реакцию: по уравнению реакции n (SO2) = (Na2SO3) = 0,1 моль V (SO2) = n (SO2) ∙ Vm = 0,1 ∙ 22,4 = 2,24 л |
| | Критерии оценивания | Баллы | | Ответ правильный и полный, включает все названные элементы. | | | Правильно записаны 1-й и 2-й элементы из названных выше. | | | Правильно записан один из названных выше элементов (1‑й или 2‑й). | | | Все элементы ответа записаны неверно. | | | Максимальный балл | | С2) -5В 
С3) Для проведения эксперимента предложены следующие реактивы: медь, оксид меди(II) и растворы гидроксида натрия, сульфата железа(II), пероксида водорода, серной кислоты. Вам также предоставлен комплект лабораторного оборудования, необходимого для проведения химических реакций. Используя необходимые вещества только из этого списка, получите в результате проведения двух последовательных реакций гидроксид меди(II). Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций. Для второй реакции составьте сокращённое ионное уравнение. | Содержание верного ответа и указания по оцениванию(допускаются иные формулировки ответа, не искажающие его смысла) | Баллы | | Составлена схема превращений, в результате которой можно получить гидроксид меди(II): 1) CuO → CuSO4→ Cu(OH)2 Составлены уравнения двух проведённых реакций: 2) CuO + H2SO4 = CuSO4 + H2O 3) CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4 Составлено сокращённое ионное уравнение второй реакции: 4) Cu2+ + 2OH– = Cu(OH)2 | | | Ответ правильный и полный, содержит все названные элементы | | | Правильно записаны три элемента ответа | | | Правильно записаны два элемента ответа | | | Правильно записан один элемент ответа | | | Все элементы ответа записаны неверно | | | Максимальный балл | 4 | С3) 

С3) 
С3) 
С3) 
С3) 
Подготовьте лабораторное оборудование, необходимое для проведения эксперимента. Проведите реакции в соответствии с составленной схемой превращений. Сделайте вывод о химических свойствах веществ (кислотно-оснόвных, окислительно-восстановительных), участвующих в реакции и классификационных признаках реакций. | | Содержание верного ответа и указания по оцениванию(допускаются иные формулировки ответа, не искажающие его смысла) | Баллы | | К1 | Проведены реакции в соответствии с составленной схемой, и описаны изменения, происходящие с веществами в ходе проведения реакций: 1) для первой реакции: растворение чёрного порошка оксида меди(II) и появление голубой окраски раствора; 2) для второй реакции: выделение голубого осадка гидроксида меди(II); 3) сформулирован вывод о свойствах веществ и классификационных признаках проведённых реакций: в основе проведённого эксперимента лежит реакция оснόвного оксида с раствором кислоты с образованием соли и воды; а также ионного обмена между солью и щёлочью, протекающая за счёт выпадения осадка | | | Ответ правильный и полный, содержит все названные элементы | | | Правильно записаны два элемента ответа | | | Правильно записан один элемент ответа | | | Все элементы ответа записаны неверно | | | К2 | Оценка техники выполнения химического эксперимента: · соблюдение общепринятых правил при отборе нужного количества реактива; · соблюдение правил безопасного обращения с веществами и оборудованием при проведении химических реакций | | | При проведении эксперимента полностью соблюдались все правила отбора реактивов и проведения химических реакций | | | При проведении эксперимента были нарушены требования правил отбора реактивов или проведения химических реакций | | | При проведении эксперимента были нарушены правила отбора реактивов и проведения химических реакций | |
|