 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Растворы электролитов. Активность, ионная сила, изотонический коэффициент. 12
Электролит – раствор или расплав какого-либо твердого или жидкого вещества, способный диссоциировать на ионы. Процесс распада электролита на ионы называется электролитической диссоциацией. По способности к диссоциации электролиты условно подразделяют на сильные, средние и слабые. У сильных электролитов > 30%, у слабых < 3%. Различие сильных и слабых электролитов состоит не столько в степени диссоциации, а в основном в поведении их в растворе, в степени отличия от идеальных растворов. К сильным электролитам относятся вещества HCl, HBr, HI, HNO3, H2SO4 (разбавл.), HClO4, NaOH, KOH, Ba(OH)2, Ca(OH)2, почти все соли. К слабым электролитам относятся органические кислоты, HCN, HF, H3BO4, H2CO3, H2S, NH4OH, Fe(OH)2, Fe(OH)3, H2O, HgCl2, CdCl2. К электролитам средней силы относятся H3PO4, H2C2O4, H2SO3, H2Ca2O3. Ионная сила раствора Поведение иона в растворе сильного электролита характеризуется некоторой функцией от концентрации электролита, которая учитывает различные электростатические взаимодействия между ионами. Эта функция называется ионной силой раствора и обозначается I. Ионная сила раствора равна полусумме произведений концентрации C всех ионов в растворе на квадрат их заряда z:
Если в растворе содержатся только однозарядные ионы бинарного электролита, то ионная сила раствора численно равна молярности раствора (для этого в формулу введен множитель ½. Если в растворе содержатся несколько электролитов в разных концентрациях, то при вычислении ионной силы учитывается вклад всех ионов. Слабые электролиты вносят очень незначительный вклад в ионную силу раствора, поэтому, если они содержатся в растворе, их обычно не учитывают в расчете ионной силы. С повышением ионной силы раствора растворимость малорастворимого электролита в его насыщенном растворе несколько возрастает. Это явление получило название солевого эффекта. Активность Активность – величина, характеризующая межмолекулярные и межионные взаимодействия, как бы снижающие концентрация ионов в растворе. Активность – величина, подстановка которой вместо концентрации в термодинамические соотношения позволяет применять их для описания рассматриваемых систем. Активность характеризует активную концентрацию электролита в растворе, отражает суммарно все эффекты взаимодействия ионов в между собой и с молекулами растворителя. Активность является мерой реального поведения вещества в растворе. Активность обычно выражают в тех же единицах, что и концентрацию, например, в моль/л. Если пользоваться значениями активности, то законы химического равновесия можно применить и к сильным электролитам. Тогда в выражении для константы диссоциации будут стоять активности, а не концентрации ионов. Коэффициент активности Коэффициент активности характеризует степень отклонения поведения реального раствора от идеального. Коэффициент активности равен отношению активности к концентрации раствора. Активность и коэффициент активности рассчитываются двумя способами. Оба они позволяют определить активность электролита в целом, а не отдельных его ионов. Первый способ состоит в сравнении свойств данного раствора с идеальным. Строится график зависимости свойств раствора от концентрации, а потом полученный график экстраполируется для бесконечно разбавления (предполагается, что при бесконечном разбавлении раствор стремится к идеальному). Второй способ вычисления активности и коэффициента активности связан с представлением об ионных атмосферах. На основе этих представлений вычисляется электрический потенциал иона по отношению к окружающей его ионной атмосфере, которая при удалении от центрального иона уменьшается, постепенно переходя в состояния чистого растворителя или идеального раствора. Изменение изобарного потенциала при переносе растворенного вещества из реального раствора в идеальный (перенос центрального иона из ионной атмосферы в идеальный раствор) является функцией коэффициента активности. Коэффициент активности связан с ионной силой соотношением:
Степень диссоциации, изотонический коэффициент Степень диссоциации является количественной характеристикой степени диссоциации раствора. Степень диссоциации равна отношению числа распавшихся на ионы молекул к общему числу молекул растворенного вещества. У сильных электролитов степень диссоциации в разбавленных растворах велика и мало зависит от концентрации раствора. У слабых электролитов степень диссоциации мала и уменьшается с увеличением концентрации раствора. Степень диссоциации слабых электролитов рассчитывается по уравнению Оствальда. Обозначим число молей растворенного вещества через С, а степень диссоциации через . Тогда в растворе продиссоциировало С моль и образовалось С моль каждого вещества. Тогда константа диссоциации (константа равновесия процесса диссоциации) составит:
где V – разбавление раствора (величина, обратная концентрации). Т.к. у слабых электролитов 0, то уравнение Оствальда можно записать (считая, что 1 - 1): Для определения степени диссоциации необходимо знать число получающихся при диссоциации частиц. Это число может быть определено изучением свойств, зависящих от числа частиц в растворе (коллигативных свойств), например, измерением понижения давления пара над раствором. Экспериментально найденные количественные характеристики коллигативных свойств раствора больше, чем вычисленные для того же раствора по его молярной концентрации в предположении отсутствия диссоциации. Для характеристики этой разницы вводится изотонический коэффициент i = pэксп / ррасч. Зная изотоничесикий коэффициент, легко определить число частиц в растворе и, следовательно, степень диссоциации.
47. Сильные и слабые электролиты. Кислоты и основания. Амфотерные электролиты. По способности к диссоциации электролиты условно подразделяют на сильные, средние и слабые. У сильных электролитов > 30%, у слабых < 3%. Различие сильных и слабых электролитов состоит не столько в степени диссоциации, а в основном в поведении их в растворе, в степени отличия от идеальных растворов. К сильным электролитам относятся вещества HCl, HBr, HI, HNO3, H2SO4 (разбавл.), HClO4, NaOH, KOH, Ba(OH)2, Ca(OH)2, почти все соли. К слабым электролитам относятся органические кислоты, HCN, HF, H3BO4, H2CO3, H2S, NH4OH, Fe(OH)2, Fe(OH)3, H2O, HgCl2, CdCl2. К электролитам средней силы относятся H3PO4, H2C2O4, H2SO3, H2Ca2O3. Амфотерные электролиты Амфотерные электролиты – соединения, которые в зависимости от условий способны проявлять либо кислотные, либо основные свойства. Амфолиты –слабые электролиты, обнаруживающие основные свойства с сильной кислотой и кислотные свойства с сильным основанием. Ярким примером амфотерного электролита является гидроскид алюминия. Его осадок может растворяться как в растворах кислот, так и щелочей. Понятие амфотерности может быть распространено и на простые вещества. Например, алюминий растворяется в растворах кислот и щелочей. К амфотерным электролитам также относятся также вещества, у которых кислотные и основные свойства обусловлены совместным присутствием кислотной и основной групп. К таким веществам относятся аминокислоты (NH2RCOOH). Среда растворов сильных и слабых кислот и оснований (расчет рН) В растворах сильных кислот и оснований типа HCl, HNO3, NaOH, KOH молярная концентрация ионов водорода совпадает и гидроксид-ионов совпадает с молярной концентрацией кислоты и основания. При расчетах рН использование аналитических концентраций допустимо только для очень разбавленных растворов, в которых активности практически равны концентрациям ионов. Если рассчитывать рН достаточно концентрированных растворов через активности, то его значения оказываются несколько завышенными. Существуют различные методы определения концентрации ионов водорода. Один из них основан на использовании кислотно-основных индикаторов. Индикатор изменяет свой цвет в зависимости от среды растворов. Другой метод расчета концентрации (титрование) состоит в приливании к исследуемому раствору кислоты раствор щелочи известной концентрации или наоборот. В какой-то момент устанавливается значение рН, при котором наступает нейтрализация кислоты и основания. рН растворов слабых кислот и оснований вычисляется с использованием их констант диссоциации. Концентрации ионов водорода и кислотного остатка, на которые распадается кислота у слабых одноосновных кислот равны. В слабых электролитах концентрация непродиссоциировавших молекул приблизительно равна концентрации самой кислоты. Поэтому константа равновесия Ккисл = Теория сильных электролитов Сильные электролиты - электролиты, которые в растворе содержатся только в виде ионов. Сильный электролит даже в кристаллическом состоянии находится в виде ионов, но имеет в растворах степень диссоциации меньше 100%. Электропроводность растворов сильных электролитов меньше, чем можно было бы ожидать при полной диссоциации растворенного вещества. Эти особенности свойств сильных электролитов не описываются теорией электролитической диссоциации. Расчет степени диссоциации по давлению насыщенного пара над раствором, по повышению температуры кипения и понижению температуры замерзания предполагает, что раствор идеален. Приложение теории идеальных электролитов к реальным связано с рядом отклонений. Кроме того ионы электролита взаимодействуют с молекулами раствора. Сольватация иона – образование вокруг иона любого заряда оболочки из молекул растворителя. В растворах электролитов имеет место и межионное взаимодействие, в результате которого вокруг каждого иона образуется ионное облако из противоположно заряженных ионов – ионная атмосфера. Таким образом, в реальных растворах нет свободных ионов, следовательно, к ним нельзя применять закон действующих масс. Расстояние между ионами в растворах сильных электролитов настолько малы, что, если кинетическая энергия теплового движения недостаточна для преодоления сил взаимного притяжения между ионами, возможно образование ионной пары. Ионная пара в некоторых отношениях подобна недиссоциированной молекуле. Содержание ионных пар достигает нескольких процентов в очень концентрированных растворах. pH= -lg[H+]; <7 – кисл, >7 – основн. ПР При образовании осадка сильного электролита между осадком и раствором устанавливается химическое равновесие. Небольшая часть молекул вещества постоянно переходит в виде ионов в раствор. Одновременно из раствора такое же количество ионов переходит в осадок вещества: Ba2+ + SO4 2- ⇔ BaSO4 (тв). Если учесть, что концентрация BaSO4 в насыщенном растворе постоянна, то, применив закон действующих масс, можно написать: [ ] [ ] [ ] 1 BaSO Ba SO K + ⋅ − = . В насыщенном растворе малорастворимого электролита произведение концентраций его ионов при постоянной температуре является постоянной величиной и называется произведением растворимости (ПР или L). ПР = К1[BaSO4] = [Ba2+]⋅[SO4 2-]. В общем виде для осадка состава ВyAx равновесие между твердой фазой и ионами Вх+ и Ау - выражается уравнением: xАу - + yВх+ ⇔ ВyAx. Константа равновесия или произведение равновесия ПР имеет вид: ПР=[Ау-]x [Вх+]y. (1.41) Правило произведения растворимости можно применить только к трудно растворимым веществам, в насыщенных растворах, в которых концентрация ионов очень мала. Понятие произведения растворимости является частным случаем общего понятия постоянства произведения активности ионов в насыщенном растворе электролита. Произведение растворимости ПР позволяет управлять процессом образования осадка. Если ионное произведение ИП (произведение концентраций ионов, образующих осадок) меньше ПР, то осадок не образуется, т.к. концентрация ионов в растворе ниже равновесной. Если ИП > ПР, то образуется осадок. Образование осадка продолжается до уравнивания ионного произведения и произведения растворимости. Наступает равновесие и дальнейшее образование осадка прекращается. Из произведения растворимости можно определить растворимость осадков S (Р). Если осадок образован ионами одинаковой зарядности и имеет состав МА, то в растворе над осадком молекулы распадаются на одинаковое количество катионов М+ и анионов А-. Растворимость осадка можно представить как концентрации либо М+, либо А-, т.к. они равны концентрации растворившихся молекул МА: МА(тв) ⇔ М+ + А-; ПР = [М+]⋅[ А-]; [М+] = [ А-]; ПР = [М+]2. S = M+ = ПР [ ] ; S = ПР (1.42). В общем случае для осадка состав МnАm произведение растворимости и растворимость связаны уравнениями: m n mm nn L S + ⋅ = ; (1.43) ПР = S m+n ⋅(mm ⋅ nn ) . (1.44) На растворимость осадка влияют различные факторы. Растворимость осадка электролита повышается, если понизить концентрацию в растворе одного из его ионов (связать в малодиссоциированное соединение) При невысокой ионной силе раствора, когда коэффициенты активностей ионов электролита можно считать близкими к единице, произведение растворимости соли приближается к произведению активностей. Правило произведения растворимости позволяет: • вычислять концентрацию ионов малорастворимой соли в насыщенном растворе, • вычислить концентрацию реагента – осадителя, необходимую для практически полного осаждения, • оценить возможность образования осадка в данных условиях и т.д. Степень гидролиза Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр); Является количественной характеристикой гидролиза.
для соли, образованной сильной кислотой и слабым основанием:
для соли, образованной слабой кислотой и слабым основанием:
12 |



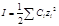
 , где z – заряд иона, f – коэффициент активности.
, где z – заряд иона, f – коэффициент активности. ,
, .
. или Н+ =
или Н+ =  . Подобным образом рассчитывается рН растворов слабых оснований.
. Подобным образом рассчитывается рН растворов слабых оснований. , где Ka — константа диссоциации слабой кислоты, образующейся при гидролизе
, где Ka — константа диссоциации слабой кислоты, образующейся при гидролизе , где Kb — константа диссоциации слабого основания, образующегося при гидролизе
, где Kb — константа диссоциации слабого основания, образующегося при гидролизе