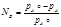ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Законы Рауля Вант-Гоффа. Эбуллиоскопия и криоскопия. 12
Условия протекания окислительно-восстановительной реакции. Уравнение Нернста. Для установления протекания электродных процессов, расчета эдс и правильного написания уравнения самопроизвольно протекающей в гальваническом элементе реакции следует поступать следующим образом: - С помощью таблицы стандартных электродных потенциалов записать уравнения реакций для каждого электрода с указанием значения электродного потенциала. - Электродную реакцию с большим отрицательным или меньшим положительным (меньшим по модулю) значением потенциала переписать в обратном направлении (при этом знак потенциала следует изменить на противоположный). - Под этим уравнением записать уравнение второй электродной реакции в том виде, в котором она дана в справочной таблице. - Умножить коэффициенты при формулах веществ на такие числа, чтобы числа принятых и отданных электронов были равны (при этом электродные потенциалы не умножаются!). - Суммируются оба уравнения и их электродные потенциалы. Таким образом получается уравнение самопроизвольно протекающей электродной реакции. То есть условием протекания окислительно-восстановительной реакции является положительное значение суммарного электродного потенциала реакции. Формула Нернста. Расчет потенциала и ЭДС при нестандартных условиях Поскольку работа окислительно-восстановительной реакции равна изобарному потенциалу, взятому с обратным знаком, G = -nEF Изменения изобарного потенциала при стандартных и нестандартных условиях связаны соотношением:
где ПС – произведение концентрация продуктов реакции и исходных веществ в степени их стехиометрических коэффициентов. Подставляя G = -nEF, получаем:
Полученное уравнение для электродного потенциала окислительно-восстановительной реакции называется уравнением Нернста. Оно позволяет вычислять с помощью таблиц Е0 значение электродных потенциалов при нестандартных условиях (в том числе нестандартных концентраций).
Св-ва разбавленных р-ров неэлектролитов. Осмотическое давление. Закон Рауля. Коллигативные свойства растворов – осмотическое давление, понижение давления пара, повышение температуры кипения (эбуллиоскопия), понижение температуры замерзания (криоскопия). Осмотическое давление: осмос – явление самопроизвольного перехода растворителя через полупроницаемую перегородку в раствор. При этом объем раствора увеличивается и возникает осмотическое давление. Осмотическое давление зависит от концентрации растовренного вещества и температуры: = СRT, где R – универсальная газовая постоянная. Закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества в растворе:
Законы Рауля Вант-Гоффа. Эбуллиоскопия и криоскопия. Закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества в растворе:
Закон Вант-Гоффа: осмотическое давление равно тому давлению, которое нужно приложить к раствору, чтобы привести его в равновесие с чистым растворителем, отделенным от него полупроницаемой перепонкой. Эбуллиоскопия: понижение давления насыщенного пара растворителя над раствором приводит к повышению температуры кипения: tкип = EC (следствие из закона Рауля), где Е – эбуллиоскопическая постоянная. Для воды она равна 0,52. Зная повышения температуры кипения и эбуллиоскопическую постоянную для данного растворителя, можно определить концентрацию раствора. Криоскопия: понижение давления насыщенного пара растворителя над раствором нелетучего вещества приводит к понижению температуры замерзания: tзам = KC (следствие из закона Рауля), где К – криоскопическая постоянная. Для воды она равна 0,86. 12 |



 ,
,