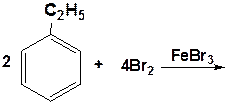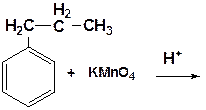ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Реакции замещения в бензольном кольце. 12
Механизм реакций – электрофильное_замещение. Галогенирование Замещение атома водорода в бензольном кольце на галоген происходит в присутствии катализаторов (кислот_Льюиса): AlCl3 С6Н6 + Cl2¾¾® С6Н5Cl + HCl хлорбензол
этилбензол п-бромэтилбензол о-бромэтилбензол Нитрование Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот): H2SO4 С6Н6 + HNO3¾¾® С6Н5NO2 + H2O нитробензол
Этилбензол п-нитроэтилбензол о-нитроэтилбензол
3. Алкилирование(реакция Фриделя-Крафтса) Замещение атома водорода в бензольном кольце на алкильную группу (алкилирование) происходит под действием алкилгалогенидов (галогеналканов) или алкенов в присутствии катализаторов (кислот Льюиса): AlCl3 С6Н6 + CH3Cl¾¾® С6Н5CH3 + HCl толуол (метилбензол)
п-диэтилбензол о-диэтилбензол AlCl3 (HCl) С6Н6 + CH3–CH=CH2¾¾¾® С6Н5CH(CH3)2 кумол (изопропилбензол)
Сульфирование В результате этой реакции происходит замещение водорода в бензольном ядре на сульфогруппу –SO3H с образованием сульфокислот (сульфоновых кислот). Бензол взаимодействует с дымящей серной кислотой (серная кислота, в которой растворен оксид серы (IV) ) при комнатной температуре. Именно нейтральная молекула оксида серы (IV) является электрофильной частицей. SO3 С6Н6 + H2SO4 (k)¾¾® С6Н5-SO3H + H2O (бензолсульфокислота)
этилбензол п-этилбензолсульфокислота о-этилбензолсульфокислота
Реакции присоединения к аренам В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом. Гидрирование Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении в присутствии металлических катализаторов: t, p, Ni С6Н6 + 3H2¾¾® С6Н12 циклогексан Эта реакция является обратной образованию бензола при дегидрировании циклогексана.
Радикальное хлорирование на свету В условиях радикальных реакций (ультрафиолетовый свет, повышенная температура) возможно присоединение галогенов к ароматическим соединениям. Практическое значение имеет радикальное хлорирование бензола для получения "гексахлорана" (средство борьбы с вредными насекомыми): hn С6Н6 + 3Cl2¾¾® С6Н6Cl6 гексахлорциклогексан (гексахлоран) В случае гомологов бензола более легко происходит реакция радикального замещения атомов водорода в боковой цепи hn С6Н5-СH3 + Cl2¾® С6Н5-СH2Cl + HCl толуол бензилхлорид
Этилбензол 1-фенил-1-хлорэтан Реакции окисления аренов Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т.п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений. В отличие от бензола его гомологи окисляются довольно легко. 1. При действии раствора KMnO4 и нагревании в гомологах бензола окислению подвергаются только боковые цепи: С6Н5-СH3 + 3[O]¾® С6Н5-СOOH + H2O толуол бензойная кислота
Окисление других гомологов (этилбензол, пропилбензол и т.д.) также приводит к образованию бензойной кислоты. Разрыв связи при этом происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи .
Пропилбензол бензойная кислота уксусная кислота
Алкильные группы в алкилбензолах окисляются легче, чем алканы. Это объясняется влиянием бензольного кольца на атомы в боковой цепи.
2. Бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким содержанием углерода в их молекулах: 2С6Н6 + 15 O2¾® 12 СO2 + 6H2O Бензол и его летучие гомологи образуют с воздухом и кислородом взрывоопасные смеси.
12 |