 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Механизм электрофильного замещения обозначается символом SЕ 12
Лекция №4 АРЕНЫ (ароматические углеводороды)
Арены или ароматические углеводороды – соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с особым характером химических связей. Простейшие представители (одноядерные арены):
С6Н6 С6Н5 СН3 бензол толуол
Многоядерные арены
нафталин С10Н8 фенантрен С14Н10
Термин "ароматические соединения" возник давно в связи с тем, что некоторые представители этого ряда веществ имеют приятный запах. Однако в настоящее время в понятие "ароматичность" вкладывается совершенно иной смысл.
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией p-электронов в циклической системе. Критерии ароматичности аренов: 1. Атомы углерода в sp2-гибридизованном состоянии образуют циклическую систему. 2. Атомы углерода располагаются в одной плоскости (цикл имеет плоское строение). 3. Замкнутая система сопряженных связей содержит 4n+2 p-электронов (n-целое число). Этим критериям полностью соответствует молекула бензола С6Н6 Строение бензола
Бензол С6Н6– родоначальник ароматических углеводородов . Каждый из шести атомов углерода в его молекуле находится в состоянии sp2-гибридизации и связан с двумя соседними атомами углерода и атомом водорода тремя s-связями.
Валентные углы между каждой парой s-связей равны 120°. Таким образом, скелет s-связей представляет собой правильный шестиугольник, в котором все атомы углерода и все s-связи С-С и С-Н лежат в одной плоскости. р-Электроны всех атомов углерода взаимодействуют между собой путем бокового перекрывания соседних 2р-АО, расположенных перпендикулярно плоскости s-скелета бензольного кольца. Они образуют единое циклическое p-электронное облако, сосредоточенное над и под плоскостью кольца. Все связи С-С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между длиной простой связи (0,154 нм) и двойной (0,134 нм). Это означает, что в молекуле бензола между углеродными атомами нет чисто простых одинарных и двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Ф.Кекуле), а все они выровнены (делокализованы). Поэтому структурную формулу бензола изображают в виде правильного шестиугольника (s-скелет) и кружка внутри него, обозначающего делокализованные p-связи . Формула Кекуле также нередко используется, но при этом учитывается, что она лишь условно передает строение молекулы. Гомологи бензола. Номенклатура и изомерия
Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R): С6Н5-R(алкилбензол), R-С6Н4-R(диалкилбензол) и т.д. Общая формула гомологического ряда бензола СnH2n-6 (n не менее 6).
Номенклатура. Широко используются тривиальные названия (толуол, ксилол, кумол и т.п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова бензол (корень):
С6Н5-СH3 С6Н5-С2H5 С6Н5-С3H7 метилбензол этилбензол пропилбензол (толуол) Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерацию кольца проводят так, чтобы номера радикалов были наименьшими. Для дизамещенных бензолов R-С6Н4-R используется также и другой способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками: орто- (о-) заместители у соседних атомов углерода кольца, т.е. 1,2; мета- (м-) заместители через один атом углерода (1,3); пара- (п-) заместители на противоположных сторонах кольца (1,4)
Ароматические одновалентные радикалы имеют общее название "арил". Из них наиболее распространены в номенклатуре органических соединений два С6Н5-фенил и С6Н5-СH2- бензил.
Изомерия (структурная): 1) положения заместителей для ди-, три- и тетра-замещенных бензолов (например, о-, м- и п-ксилолы,); 2) углеродного скелета в боковой цепи, содержащей не менее 3-х атомов углерода; 3) изомерия заместителей, начиная с С2Н5.
заместителей минимальна) Пространственная изомерия относительно бензольного кольца в алкилбензолах отсутствует. Свойства аренов Физические свойства Бензол и его ближайшие гомологи – бесцветные жидкие вещества, нерастворимые в воде, но хорошо растворяющиеся во многих органических жидкостях. Легче воды. Огнеопасны. Бензол токсичен (вызывает заболевание крови – лейкемию). Химические свойства По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Это объясняется особенностями строения бензольного кольца. Делокализация шести p-электронов в циклической системе понижает энергию молекулы, что обусловливает повышенную устойчивость (ароматичность) бензола и его гомологов. Поэтому арены не склонны вступать в реакции присоединения или окисления, которые ведут к нарушению ароматичности. Для них наиболее характерны реакции, идущие с сохранением ароматической системы, а именно, реакции замещения атомов водорода, связанных с циклом. Наличие областей повышенной p-электронной плотности с двух сторон плоского ароматического цикла ведет к тому, что бензольное кольцо является нуклеофилом и в связи с этим склонно подвергаться атаке электрофильным реагентом. Таким образом, для ароматических соединений наиболее типичны реакции электрофильного замещения. Механизм электрофильного замещения обозначается символом SЕ (по первым буквам английских терминов: S – substitution [замещение], E – electrophil [электрофил]). Другие реакции (присоединение, окисление) идут с трудом.
Электрофильное замещение (SE)– механизм реакции взаимодействия ароматических углеводородов с молекулами, содержащими электрофильные частицы. Взаимное влияние атомов в молекуле – одно из основных положений теории химического строения А.М.Бутлерова, которое играет исключительно важную роль в органической химии. Примером взаимного влияния атомов на химическое поведение молекулы является толуол С6Н5-СH3. Под влиянием метильной группы СH3 (проявляющей +I-эффект) повышается электронная плотность в бензольном кольце на атомах С2 ,С4 и С6 . Это приводит к более легкому гетеролитическому разрыву соответствующих С-Н-связей и ускоряет реакции электрофильного замещения в кольце. Поэтому нитрование толуола происходит значительно активнее (даже без нагревания), чем бензола. При этом замещению подвергаются не один, а три атома водорода в положениях 2, 4 и 6, т.е. местах наибольшей электронной плотности. С другой стороны, бензольное кольцо влияет на ход реакции радикального замещения атомов водорода в боковой цепи (в метильной группе) молекулы толуола: hn С6Н5-СH3 + Cl2¾® С6Н5-СH2Cl + HCl толуол бензилхлорид Эта реакция идет легче, чем замещение в метане (и вообще, в алканах). Под влиянием бензольного кольца метильная группа СH3становится более активной в реакциях радикального замещения по сравнению с метаном СH4. Это объясняется тем, что на лимитирующей стадии реакции легко (при невысокой энергии активации) образуется стабильный радикал бензил С6Н5-СH2·, в котором неспаренный электрон делокализован за счет взаимодействия с p-электронной системой бензольного кольца.
Кроме того, алкильная группа в гомологах бензола легче, чем в алканах подвергается окислению. С другой стороны, под влиянием бензольного кольца метильная группа СH3 в толуоле становится более активной в реакциях окисленияи радикального замещения по сравнению с метаном СH4 Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании.
Легче, чем в алканах, протекают реакции радикального замещения в боковой цепи алкилбензолов: hn С6Н5-СH3 + Cl2¾® С6Н5-СH2Cl + HCl толуол бензилхлорид
Это объясняется тем, что на лимитирующей стадии легко (при невысокой энергии активации) образуется радикал бензил ·СH2-С6Н5. Он более стабилен, чем алкильные свободные радикалы (·СН3, ·СH2R), т.к. его неспаренный электрон делокализован за счет взаимодействия с p-электронной системой бензольного кольца. 12 |













 фенил
фенил  бензил
бензил 2-Метил-1-пропил-3-этилбензол (по правилу алфавита 1-3)
2-Метил-1-пропил-3-этилбензол (по правилу алфавита 1-3) 1-Метил-3-пропил-5-этилбензол (по правилу алфавита1,3,5)
1-Метил-3-пропил-5-этилбензол (по правилу алфавита1,3,5)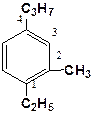 2-Метил-4-пропил-1-этилбензол (арифметическая сумма
2-Метил-4-пропил-1-этилбензол (арифметическая сумма