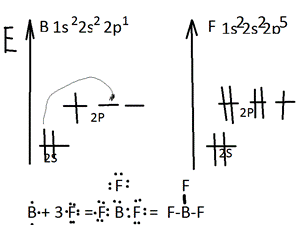ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Какие положения квантовой механики используются для описания строения атома?
Опишите строение атома водорода, используя представления о волновой функции, электронном облаке, граничной поверхности, атомной орбитали. Движение е имеет волновой хар-ер квантовая механика опис его с помощью волн ф-ии. ψ Волн функция не имеет физический смысл, а имеет его квадрат(ψ в квадр). Квадрат хар-ет его нах-ние в данном пространстве. Волн ф-ия, которая явл-ся решением, назыв-ся атомной орбиталью. А торб – область пространства вокруг ядра, в котором вероятное пребывание е. Чем прочнее связь е с ядром, тем эл. Облако меньше и плотнее по распределению заряда. Эл облако часто изображают в виде граничной поверхности.в эл облаке можно провести поверхности, на которых эл плотность будет иметь одинаковое значение. В случае атома воздуха – это сферическая поверхность.
Свойства простых тел, а также формы и св-ва соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
4.По какому признаку атомы подразделяются на s,- p-, d-, f-элементы? Каковы тенденции изменения радиуса, энергии положение в периодической системе? Покажите на конкретных примерах как определить электронную конфигурацию атома по его положению в периодической системе. Пример: Цезий (Сs) находится в 6 периоде, его 55 электронов (порядковый номер 55) распределены по 6 энергетическим уровням и их подуровням. Cоблюдая последовательность заполнения электронами орбиталей получим:
Какие положения квантовой механики используются для описания строения атома? Поведение микрообъектов можно объяснить ,используя представления квантовой механики,которая была создана в начале 20-шл столетия. Основана на : 1)квантовании энергии: Макс Планк в 1900 году высказал предположение, что энергия поглощается и испускается порциями(квантами) E=hn где h - постоянная Планка, h = 6,62х10-34Дж*с n - частота света 2)волновом характере движения микрочастиц: Луи де Бройль в 1924 году высказал предположение, что движение любой микрочастицы можно рассматривать ,как волновой процесс
Чем больше частота колебаний, 3)положение: принцип неопределенности Гейзенберга: Одновременно точно определить положение частицы и ее скорость невозможно. ∆px ∆x ≥ n/2n, Чем точнее определены координационные частицы, тем менее определенной становится величина импульса или по скорости. 6.Как теория ВС объясняет химическую связь? Определите пространственную конфигурацию PF5,H3N,NH4. Важнейшей характеристикой химической связи является энергия ,определяющая ее прочность. Для 2-х атомных молекул энергия связи равна величине энергии диссоциации молекул на атомы. Химическая связь в основном осуществляется валентными электронами. У s- и p-элементов валентными являются электроны внешнего слоя, а у d-элементов –электроны s-состояния внешнего слоя и d-состояния предвнешнего слоя. Химическая связь образуется ,если при сближении атомов полная энергия системы понижается. Согласно возможным положениям у электронов относительно 2-х протонов имеется область связывания и разрыхления. Если электрон попадает в область связывания,то хим.связь образуется. Если электрон попадает в область разрыхления, то хим.связь не образуется. Представление теории ВС химическая связь локализована между 2-я атомами,т.е. она двуцентровая и двухэлектронная. Пространственная конфигурация:
Пространственная конфигурация: PF5-тригональная би-пирамида- dsp3 H3N- треугольная пирамида- sp3 NH4-искаженный тетраэдр- sp3
7.Сформулируйте положение теории ВС. На примере молекулы N2 и иона NH4+ предложите механизм образования хим.связи .Каковы валентные возможности атомов элементов 2 периода? Положение теории ВС: 1) Единичная химическая связь образует 2 электрона с противоположными спинами, принадлежащими 2 атомам . Полная энерг.системы при этом понижается. 2) химическая связь располагается в том направлении, в котором перекрывание волновых функций наибольшее. 3)из 2 атомных орбиталей прочную связь перекрывает та орбиталь,в которой сильнее перекрывается с орбиталью другой атом.
Рассмотрим валентные возможности атомов B,C и N. Это элементы 2-го периода и их валентные электроны распределяются по четырем орбиталям внешнего слоя.
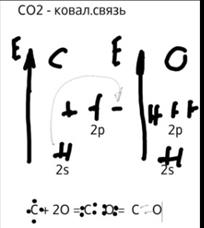
8.Сфомулируйте положение теории ВС. На примерах молекул СН4 и СО2, рассмотрите представления о насыщяемости, направленности и порядке ковалентной связи.
Тория валентных связей исходит из положения, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Таким образом, в представлении теории валентных связей химическая связь локализована между двумя атомами, т.е она двухцентровая и двухэлектронная. Основные положения ТВС 1) Единичная химическая связь образуется 2-я электронами,с противоположными спинами, принадлежащими 2 атомам . Полная энерг.системы при этом понижается. 2) химическая связь располагается в том направлении, в котором перекрывание волновых функций электронв наибольшее. 3)из 2 атомных орбиталей прочную связь образует та орбиталь, которая сильней перекрывается с орбиталью другого атома. Рассмотри в рамках теории ВС характерные особенности ковалентной связи- насыщаемость, направленность и порядок(поляризуемость) Насыщаемость – способность атомов образовывать максимальное число связей. Насыщаямость КС проявляется в том, что каждая АО может принять участие в образовании только одной КС. Это свойство обуславливает опред.состав мол- хим.соедин. способность элемента образовать хим.связи называется валентность. Направленность является главным свойством от которого зависит строение молекул. В зависимости от формы орбитали, различают 3 типа связей. (направленность ковалентной связи – параметр, определяющий пространственную структуру молекул, их геометрию, форму.) Порядок связи – это число обобществленных поделенных пар между двумя связанными атомами. Порядок связи выше трех не встречается
Насыщаемость=4 Насыщяемость=2 ЛЭП= 4 ЛЭП=(4+ 2*2)/2= 4-2=2 СЭП=4 СЭП=2 НЭП=0 НЭП=2-2=0 Порядок связи=1 Порядок связи = 2 Ответ: тетраэдрическая, sp3, 4сигма связей Ответ: Линейная, sp, 2сигма и 2 пи связи
9. Пользуясь теорией ВС, объясните состав и химическую связь молекулы BF3 и иона BF4-. Тория валентных связей исходит из положения, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Таким образом, в представлении теории валентных связей химическая связь локализована между двумя атомами, т.е она двухцентровая и двухэлектронная. Одно из важнейших свойств химической связи- насыщаемость. Вследствие насыщаемости связи молекулы имеют определенный состав и существуют в виде дискретных частиц с определенной структурой. ТВС- каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Под валентностью подразумевается свойство атома данного элемента присоединять или замещать определенное число атомов другого элемента. В настоящее время под валентностью химического элемента обычно принимается его способность к образованию химической связи. В представлении метода ВС численное значение валентности соответствует числу ковалентных связей. молекула BF3 состоит из атома В и 3 атома F.
Насыщаемость =3 . Бор и фтор неметаллы, поэтому связь будет ковалентной, образованная с помощью обменного механизма. ЛЭП= (3+3*1) / 2= 3 СЭП= 3 НЭП= 3-3= 0 Молекула имеет треугольную форму, все сигма связи, sp2- гибридизация (угол 120)
Ион BF4- состоит из катиона В3+ и 4 анионов F- . Бром и фтор неметаллы, следовательно ковалентная связь.
Ион образован с помощью донорно-акцепторного механизма ЛЭП =( 3+4*1+1) / 2 = 4 СЭП=4 НЭП= 4-4= 0 Ион имеет тетраэдрическую форму , SP3- гибридизация, обладает 4 сигма связями.( Угол 109,5)
10.Рассмотрите свойства ковалентной связи - ее насыщяемость, направленность. Каково строение молекул OF2 , NF3 , CF4 . Объясните различие валентных углов. Ковалентная связь — химическая связь, образованная перекрытием пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой. Характерные свойства ковалентной связи — направленность, насыщаемость, поляризуемость — определяют химические и физические свойства соединений.( Ковалентная связь обладает рядом важных свойств. К их числу относятся:насыщаемость и направленность) НАСЫЩАЕМОСТЬ — характерное свойство ковалентной связи. Она проявляется в способности атомов образовывать ограниченное число ковалентных связей. Это связано с тем, что одна орбиталь атома может принимать участие в образовании только одной ковалентной химической связи. Данное свойство определяет состав молекулярных химических соединений. Так, при взаимодействии атомов водорода образуется молекула Н2, а не Н3. С точки зрения МВС третий атом водорода не может присоединиться, так как спин его электрона окажется параллельным спину одного из спаренных электронов в молекуле. Способность к образованию того или иного числа ковалентных связей у атомов различных элементов ограничивается получением максимального числа неспаренных валентных электронов. НАПРАВЛЕННОСТЬ — свойство ковалентной связи, определяющее геометрическую структуру молекулы. Причина направленности связи заключается в том, что перекрывание электронных орбиталей возможно только при их определенной взаимной ориентации, обеспечивающей наибольшую электронную плотность в области их перекрывания. В этом случае образуется наиболее прочная химическая связь. СТРОЕНИЕ МОЛЕКУЛ OF2- угловая(геометрическая форма) NF3- тригональная пирамида СF4-линейная Взаимным отталкиванием связывающих и несвязывающих электронных пар центрального атома можно объяснять влияние на размеры валентных углов природы переферических атомов. Например в ряду OF2(103градуса), NF3(102), СF4(180)-отталкивающее влияние несвязывающих электронных пар в случае этих молекул приводит к уменьшению валентного угла в большей степени.
11.Сформулируйте понятие энергии Гиббса. Каковы условия принципиальной осуществимости процесса? Вычислите изменение энергии Гиббса при 1000С для реакции: C(графит) +Н2О(г) ↔ CO(г) + H2(г); дельта Н(298)=131,3кДж , дельта S(298)= 133,6 Дж/К. Какой фактор – энтальпийный или энтропийный – определяет возможность этой реакции? В химических процессах одновременно действуют два противоположных фактора — энтропийный ( Т дельта S) и энтальпийный (дельта H). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре определяет изменение энергии Гиббса (G). дельтаG= дельтаH-T дельтаS Условием принципиальной возможности процесса является неравенство дельтаG<0. Иными словами, самопроизвольно протекают реакции, если энергия Гиббса в исходном состоянии системы больше, чем в конечном (Увеличение энергии Гиббса( G>0)свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях. Если же (G=0) система находится в состоянии химического равновесия) C(графит) + H2O(г) ↔ CO(г) + H2(г) дельта Н(298)=131,3кДж, температура 1000 С (я думаю что нужно перевести в К,по формуле чтоб сократилось, следовательно Т=1273К) дельта S(298)=133,6Дж/К дельтаG=дельта H-TдельтаS = 131,1кДж – (1273К * 133,6Дж/К)= 131,1-170072,8=-169941,7 Реакция эндотермическая, протекает с увеличением объема дельта G<0 , следовательно определяется энтропийным фактором При высокой температуре энтропийный фактор перекрывает энтальпийный фактор (т.е. |дельта Н | > | Tдельта S|) и реакция протекает самопроизвольно.
12. Сформулируйте понятие энтропии. Как вычислить изменение сэнтропии в процессе: H2(г)+1/2 O2 (г)= H2O(г) Энтропия – мера беспорядка(неупорядоченности) системы. S. При протекании одних реакций система из более упорядоченного состояния(с меньшим беспорядком) переходит в менее упорядоченное(с большим беспорядком). ΔS<0 – в менее упорядоченное состояние, ΔS>0- в более упорядоченное состояние. H2(г)+1/2 O2 (г)= H2O(г) ΔS0298 = 1моль*188,72 Дж/моль*К – 1моль*130,52 Дж/моль*К – 1/2моль*205,04 Дж/моль*К= -44,32 Дж/К, ΔS<0 – беспорядка стала меньше, система сжалась. |