ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Ориентация в дизамещенных производных бензола 12
В зависимости от электронной природы заместителей и их взаимного расположения различают согласованную и несогласованную ориентацию. При согласованной ориентации оба заместителя направляют новый заместитель в одни и те же положения бензольного кольца. Согласованная ориентация характерна длядизамещенных производных бензола, в которых соблюдаются условия: 1) ориентанты одного и того же рода находятся в ^то-положении относительно друг друга:
2) заместители находятся в орто- или пара-положении по отношению друг к другу, но один из них является ориентантом I рода, а другой — II рода:
о-нитрофенол
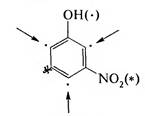
При несогласованной (несовпадающей) ориентации один из заместителей направляет новую группу в одни, а другой — в иные положения бензольного кольца. Предпочтительное направление замещения можно определить, используя следующие правила: 1) если один из заместителей является ориентантом I рода, он определяет направление замещения:
м-нитрофенол
2) если оба заместителя являются ориентантами I рода, направление замещения определяется более сильным ориентантом:
о-толуидин
3) если оба заместителя являются ориентантами II рода, замещение осуществляется с трудом, а место вхождения третьего заместителя определяется более сильным ориентантом:
о-нитробензойная кислота
Наряду с электронной природой заместителей на соотношение продуктов замещения оказывают влияние пространственные факторы. МНОГОЯДЕРНЫЕ АРЕНЫ Ароматические углеводороды, содержащие два и более бензольных ядер, относятся к многоядерным аренам. В зависимости от того, каким образом связаны бензольные кольца, многоядерные арены делятся на две группы: • арены с конденсированными и (анелированными) бензольными циклами; • арены с неконденсированными (изолированными) бензольными циклами. МНОГОЯДЕРНЫЕ АРЕНЫ С КОНДЕНСИРОВАННЫМИ БЕНЗОЛЬНЫМИ ЦИКЛАМИ Конденсированные многоядерные арены содержат в своем составе два или более бензольных ядра, имеющих общие атомы углерода. Наиболее важными представителями конденсированных аренов являются нафталин, антрацен и фенантрен.
НАФТАЛИН Нафталин состоит из двух конденсированных бензольных колец Два атома углерода (9 и 10) общие для двух колец.
В отличие от бензола атомы углерода в молекуле нафталина неравноценны. Положения 1, 4, 5, 8 равнозначны, их принято обозначать буквой α и называть α-положениями. Положения 2, 3, 6 и 7 также равнозначны и их обозначают буквой β и называют β-положениями. Для монозамешенного нафталина возможно 2 изомера (α- и β-), а при наличии двух одинаковых заместителей — 10 изомеров.
В номенклатуре дизамещенных нафталинов наряду с цифровым обозначением положений заместителей применяют также и приставки: орто-положение —1,2, мета —1,3, пара —1,4, пери —1,8, амфи — 2, 6. Например:
Радикалы нафталина называют нафтилами:
Способы получения 1. Природные источники. В промышленности нафталин, главным образом, получают из каменноугольной смолы, где его содержание составляет около 10 %. Наряду с нафталином из каменноугольной смолы выделяют также некоторые его моно- и диметильные производные. 2. Получение нафталина из ацетилена. При пропускании ацетилена через нагретые до 700—800 °С трубки наряду с бензолом образуется также и нафталин.
Физические свойства Нафталин — бесцветное кристаллическое вещество с характерным запахом, сублимируется при 81 °С. Не растворяется в воде, растворяется в органических растворителях. Применяется в быту для борьбы с молью, в химии красителей, для получения лекарств, пластмасс, глифталевых смол. Строение нафталина Электронное строение нафталина сходно со строением бензола. Его молекула плоская. Дипольный момент равен нулю, но электронная плотность распределена не так равномерно, как в молекуле бензола. Более высокая электронная плотность α-положений нафталина делает их более реакционноспособными по сравнению с β-положениями. Длина связей в молекуле нафталина разная.
Химические свойства нафталина Нафталин, как и бензол, проявляет свойства ароматических соединений и для него характерны, прежде всего, реакции электрофильного замещения, но он также легко вступает в реакции присоединения и окисления. 1.Реакции электрофильного замещения. В реакции электрофильного замещения (нитрование, сульфирование, галогенирование) нафталин вступает значительно легче бензола. При этом образуются в основном продукты α-замещения. Это обусловлено тем, что в α-положении нафталинового ядра выше электронная плотность и при атаке в α-положение образуется более стабильный σ-комплекс, чем в β- положении:
Как видно, при атаке α-положения делокализация положительного заряда в σ-комплексе происходит с сохранением ароматичности одного из бензольных ядер в возможных резонансных структурах. В случае атаки электрофилом β-положення, лишь в одном случае возможно сохранение ароматичности бензольного ядра. Следовательно, замещение по α-положению энергетически более выгодно. Нитрование. Нафталин довольно легко нитруется нитрующей смесью с образованием в основном α-изомера:
Сульфирование. Для сульфирования нафталина используют концентрированную H2S04, причем в зависимости от температуры, при которой проводится реакция, получают α- или β-продукты замещения. При температуре 80 °С реакционной среды образуется α-нафталин-сульфокислота, а при 160 °С — β-нафталинсульфокислота:
При нагревании α-изомера до температуры 160 °С он полностью превращается в β-нафталинсульфокислоту. Галогенирование. При температуре 90—110 °С в присутствии катализатора — FeCl3, нафталин хлорируется с образованием преимущественно α-хлорнафталина. Реакция протекает по механизму SE:
Галогенирование нафталина возможно и без катализатора. Тогда вначале протекает реакция присоединения галогена, а затем отщепления галоген водорода. Например, при взаимодействии брома с нафталином, бром присоединяется в положения 1 и 4, а затем продукт присоединения отщепляет молекулу бромводорода, образуя α-бромнафталин:
Правила ориентации в нафталиновом ядре Правила ориентации в нафталиновом ядре имеют свои особенности. Направление электрофильного замещения в монозамещенных производных нафталина определяется электронной природой уже имеющегося заместителя и большей реакционной способностью α-положения. При наличии в нафталиновом ядре электронодонорного заместителя электронная плотность повышается прежде всего в том кольце, с которым связан заместитель, и поэтому реакция электрофильного замещения происходит именно в этом кольце. Замещение, прежде всего, идет по 4 положению (α-положение).
Например, нитрование 1-метилнафталина приводит к образованию 1 -метил-4-нитронафталина:
Электроноакцепторный заместитель понижает электронную плотность в нафталиновом ядре и прежде всего в том кольце, с которым он связан. Поэтому реакции идут с участием атомов углерода второго бензольного ядра. Так как α-положения более реакционноспособны, то замещение происходит преимущественно в положения 5 и 8.
Например, нитрирование 1-нитронафталина нитрующей смесью приводит к образованию смеси изомеров:
2.Реакции присоединения Реакция восстановления. Присоединение водорода идет вначале по a-положению. Затем образуется 1.2,3,4-тетрагидронафталин, который при 200 °С гидрируется с образованием декагидронафталина—декалина:
Тетралин используется как топливо и растворитель для жиров и смол. Декалин используется как растворитель для лаков, является заменителем скипидара. 3.Реакции окисления В отличие от бензольного, нафталиновое ядро легко окисляется и при окислении гомологов нафталина окисляется само ядро. Например:
Окисление нафталина в присутствии V205 приводит к образованию фталевого ангидрида:
АНТРАЦЕН Это многоядерное соединение, состоящее из трех линейно конденсированных бензольных колец. В молекуле антрацена нумеруются лишь атомы углерода, несушие водород. Положения 1,4, 5, 8 — называют α-положениями; 2, 3, 6, 7 — β-положениями; 9, 10 - γ-положениями или μ-(мезо - средний) положениями.
При одном заместителе в ядре возможно 3 изомера — α, β, γ. Способы получения Антрацен находится в каменноугольном дегте, а именно в антраценовом масле, в количестве 0,5 %, откуда его и добывают в промышленности. В лаборатории можно получить антрацен по реакции Фриделя — Крафтса из бензола и 1,1,2,2-тетрабромэтана в присутствии А1Вг3:
Физические свойства Антрацен — это бесцветное кристаллическое вещество, tпл равна 217 °С, перегоняющееся с водяным паром, растворимо в бензоле, эфире, нерастворимо в воде. Растворы обладают голубой флюоресценцией. Химические свойства Антрацен обладает меньшей ароматичностью, чем бензол и нафталин. Он в большей мере «ненасыщенное» соединение и для него более характерны реакции присоединения, чем электрофильного замещения. Наиболее реакционноспособными в молекуле антрацена являются мезо-положения (положение 9 и 10). 1. Реакция восстановления. Антрацен легко присоединяет водород с образованием 9,10-дигидроантрацена. Дальнейшее его гидрирование приводит к пергидроантрацену.
2. Реакции замещения. Галогенирование антрацена происходит по механизму присоединения-отщепления. Например:
Нитрование антрацена азотной кислотой в среде уксусной кислоты при комнатной температуре ведет к образованию 9-нитроантрацена. В результате сульфирования антрацена серной кислотой при нагревании образуются α- и β-изомеры, которые являются более устойчивыми, чем γ.
3. Реакция окисления. Антрацен очень легко окисляется концентрированной азотной кислотой или хромовой смесью до антрахинона.
Антрахинон — это желтое кристаллическое вещество, обладающее свойствами хинонов. ФЕНАНТРЕН Структурным изомером антрацена является фенантрен. В антрацене три бензольных кольца соединены линейно, тогда как в фенантрене они соединяются ангулярно, т. е. под углом.
С увеличением числа ароматических колец в многоядерных соединениях растет число монозамешенных изомеров: так для нафталина возможны два продукта (α,β), для антрацена — три, для фенантрена — 5.
Цифрами обозначены положения, в которых могут находиться за- местители. Получение Получают фенантрен в основном из каменноугольной смолы. Физические свойства фенантрена Фенантрен — это твердое кристаллическое вещество с tпл = 101 °С, tкип = 340,2 °С. Растворяется в эфире, бензоле, трудно — в спирте. Растворы имеют голубую флуоресценцию. Химические свойства Фенантрен. как и антрацен, обладает более слабым ароматическим характером, чем нафталин, и тем более, чем бензол. Электронная плотность в его молекуле распределяется неравномерно, ароматичность среднего бензольного кольца здесь настолько нарушена, что связь между 9 и 10 атомами углерода приобретает характер двойной связи. Реакции замещения протекают по механизму присоединения - отщепления. Так, вначале присоединяется бром в 9 и 10 положениях с последующим отщеплением НВг и образованием 9-бромфенантрена:
9,10-Дибром-9,10-дигидрофенантрен может быть выделен в свободном состоянии. При окислении фенантрена образуется фенантренхинон. При дальнейшем окислении идет разрыв связи С9—С10 и образуется дифеновая кислота:
При восстановлении фенантрена образуется продукт, который носит название пергидрофенантрен.
Конденсированная система пергидрофенантрена и циклопентана называется циклопентанпергидрофенантрен. или стеран.
Данная структура лежит в основе стероидов.
МНОГОЯДЕРНЫЕ АРЕНЫ С ИЗОЛИРОВАННЫМИ БЕНЗОЛЬНЫМИ ЦИКЛАМИ Наиболее важными представителями этой группы соединений являются бифенил, дифенилметан и трифенилметан.
БИФЕНИЛ Молекула бифенила содержит два бензольных кольца, соединенных σ-связью. Нумерацию каждого бензольного ядра проводят отдельно.
Способы получения 1. Бифенил выделяют из каменноугольной смолы, где он содержится в небольшом количестве. 2. Дегидрогенизация бензола. Пары бензола пропускают через раскаленные трубки. Выход бифенила достигает 70 %.
3. Реакция Ульмана. Нагревание йодбензола в присутствии порошка меди:
Физические свойства Бифенил — твердое вещество с tпл 70 °С, легко растворим в спирте, эфире. Строение. Химические свойства Два бензольных кольца в молекуле бифенила соединены между собой σ-связью, длина которой (0,148 нм) несколько меньше длины углерод-углеродной связи в алканах (0,154 нм). Вокруг σ-связи в молекуле бифенила возможно свободное вращение, при этом барьер вращения невелик. Но если в орто-положениях обоих бензольных колец содержатся объемные заместители, то из-за пространственных препятствий вращение вокруг σ-связи, соединяющей два цикла, сильно затрудняется или становится невозможным Бензольные кольца располагаются под углом. Если в орто-положениях каждого бензольного ядра молекулы бифенила находятся разные заместители, то такие соединения проявляют оптическую активность. Обусловлено это тем, что эти соединения хотя и не содержат асимметрического атома углерода (центра хиральности), не имеют также и плоскости симметрии. Их молекула асимметрична в целом. Так, 6,6-динитродифеновая кислота существует в виде двух энан- тиомеров (зеркальных изомеров):
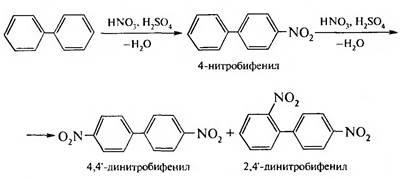
Вид пространственной изомерии, обусловленный ограничением свободного вращения вокруг простой связи, называется атропизомерией (от греч. атропо — нет поворота). Для проявления атропизомерии необязательно наличие четырех заместителей в орто-положениях, иногда достаточно трех или даже двух объемных заместителей. Химические свойства Химические свойства бифенила аналогичны свойствам моноядерных аренов. Для него характерны реакции электрофильного замещения (нитрование, галогенирование, сульфирование и т. д.). В эти реакции бифенил вступает легче, чем бензол, при этом образуются преимущественно продукты пара- и орто-замещения. Связано это с тем, что фенильные группы оказывают по отношению друг к другу слабые электронодонорные свойства, т. е. одно из колец при этом выполняет роль заместителя I рода.
Нитрогруппа в молекуле 4-нитробифенила уменьшает электронную плотность, прежде всего в бензольном кольце, в котором она находится, поэтому вторая нитрогруппа вступает в незамещенное ядро. ДИФЕНИЛМЕТАН В молекуле дифенилметана два бензольных цикла связаны через метиленовую группу. Нумерацию углеродных атомов в каждом цикле проводят отдельно:
Способы получения Дифенилметан получают по реакции Фриделя — Крафтса алки- лированием бензола бензилхлоридом или дихлорметаном:
Физические свойства Дифенилметан — твердое кристаллическое вещество с tпл 26— 27 °С и запахом герани, он легко растворим в спирте, диэтиловом эфире, хлороформе. Химические свойства Для дифенилметана характерны реакции с участием бензольных циклов и активной метиленовой группы. Как ароматический углеводород дифенилметан вступает в реакции электрофильного замещения, образуя 4,4-дизамешенные и 2,4,2,4-тетразамещенные продукты:
Атомы водорода метиленовой группы в молекуле дифенилметана подвижны вследствие электроноакцепторного действия фенильных групп. В результате дифенилметан легко окисляется:
Бензгидрол является исходным продуктом при получении димедрола— (С6Н5)2СНОСН2СН2Ы(СН3)2-НС1 —антигистаминного средства. Водородные атомы метиленовой группы также легко замещаются на галоген:
Дифенилметан используется в парфюмерной промышленности для отдушки мыл; некоторые его производные являются пестицидами. ТРИФЕНИЛМЕТАН В молекуле трифенилметана три бензольных цикла связаны через метановую группу (СН):
Способы получения Трифенилметан получают по реакции Фриделя—Крафтса из хлороформа и бензола:
Физические свойства Трифенилметан — кристаллическое вещество с tпл 76 °С, трудно растворимое в воде, легко — в органических растворителях. Химические свойства По химическим свойствам трифенилметан во многом напоминает дифенилметан. Для него также характерны реакции электрофильного замещения с участием бензольных циклов и реакции с участием атома водорода метиновой группы. Фенильные радикалы проявляя -I-эффект смещают на себя электронную плотность с атома углерода СН-группы. вследствие чего атом водорода этой группы приобретает подвижность и легко замещается на металлы и галогены. За счет метиновой группы трифенилметан легко окисляется. Так, при действии амида натрия в жидком аммиаке трифенилметан образует трифенилметилнатрий:
Трифенилметилнатрий окрашен в желтый цвет, он имеет ионное строение, его эфирные растворы проводят электрический ток. Стабильность трифенилметил-аниона и наличие окраски объясняется тем, что в делокализации отрицательного заряда принимают участие все три бензольных ядра:
При взаимодействии трифенилметана с хлором атом водорода СН-группы замешается на хлор, продуктом реакции является трифе- нилхлорметан. Атом хлора в его молекуле очень подвижен. При растворении трифенилхлорметана в жидком S02 (растворитель с высокой диэлектрической постоянной) в присутствии АlCl3 происходит его ионизация с образованием трифенилметил-катиона:
При окислении трифенилметана образуется трифенилкарбинол, который подвергается ионизации в концентрированной серной кислоте:
Устойчивость трифенилметил-катиона также обусловлена участием бензольных колец в делокализации положительного заряда за счет сопряжения:
При обработке трифенилхлорметана цинком в бензольном растворе образуется свободный трифенилметильный радикал, находящийся в равновесии со своим димером:
Трифенилметильный радикал — это первый радикал, полученный в свободном виде. Он был получен в 1900 г. американским химиком М. Гомбергом. Столь высокая устойчивость трифенилметила по сравнению с алкильными радикалами объясняется значительной делокализацией неспаренного электрона по всем бензольным кольцам.
Свободный радикал трифенилметила окрашен в желтый цвет. Красители трифенилметанового ряда К красителям трифенилметанового ряда относятся бриллиантовый зеленый и фенолфталеин. Бриллиантовый зеленый — представитель аминопроизводных трифенилметана. Его получают конденсацией бензальдегида с N,N-ди- этиланилином в присутствии кислотного катализатора (хлороводородной кислоты) согласно схеме:
Бриллиантиновый зеленый применяется в медицине в виде 1—2 % водных или спиртовых растворов как антисептическое средство, а также при изготовлении бактерицидных пластырей. Фенолфталеин является представителем гидроксипроизводных три- фенилметана. Получают фенолфталеин конденсацией фенола с фталевым ангидридом в присутствии концентрированной кислоты:
Фенолфталеин представляет собой белое кристаллическое вещество с tпл 259—263 °С, практически нерастворимое в воде, хорошо растворимое в этаноле. Фенолфталеин применяется в аналитической практике как кислотно-основный индикатор. В кислой и нейтральной среде он находится в бесцветной лактонной форме, в щелочной среде (при pH 8,2—10,0) приобретает малиновую окраску вследствие образования хиноидной структуры.
Фенолфталеин применяется в медицине как слабительное средство при хронических запорах.
12 |



 м-толуидин
м-толуидин


 нафталин антрацен фенантрен
нафталин антрацен фенантрен