ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ) 12
Лекция 9.
Ароматическими первоначально называли органические соединения, которые или сами имели приятный запах, или же выделялись из природных вешеств, обладающих приятным запахом. Впоследствии среди них были обнаружены соединения с приятным и неприятным запахом, а также соединения без запаха. Однако название за большой группой органических соединений, проявляющих сходные с бензолом свойства, сохранилось. К ароматическим углеводородам или аренам относятся соединения, молекулы которых содержат одно или несколько бензольных колец. В зависимости от числа бензольных циклов, входящих в состав молекулы, различают одноядерные (моноциклические) и многоядерные (полициклические) арены. МОНОЯДЕРНЫЕ АРЕНЫ Простейшим представителем одноядерных ароматических соединений является бензол (С6Н6). Впервые бензол был получен английским ученым М. Фарадеем в 1825 г. из светильного газа, образующегося в процессе переработки каменного угля. Однако строение его молекулы в течение многих лет оставалось загадкой для химиков. Несмотря на то, что формула С6Н6 предполагает достаточно выраженный ненасыщенный характер, бензол, в отличие от непредельных соединений, оказался относительно инертным веществом. Он сравнительно устойчив к нагреванию и действию окислителей, практически не вступает в характерные для ненасыщенных соединений реакции присоединения. Наоборот, для бензола более характерными оказались не свойственные непредельным соединениям реакции замещения. Составу С6Н6 приписывались разные структурные формулы, но все они не объясняли в полной мере химических свойств бензола. В 1865 г. немецкий химик Кекуле предложил формулу бензола, представляющую собой цикл из шести атомов углерода с чередующимися простыми и двойными связями:
Формула Кекуле предполагает равноценность всех атомов углерода и водорода в молекуле. В соответствии с формулой Кекуле бензол должен иметь два 1,2- дизамещенных изомера:
Экспериментально же было установлено, что 1,2-дизамещенные производные бензола не имеют изомеров положения, т. е. они существуют в виде одного соединения. Для объяснения этого противоречия в 1872 г. Кекуле выдвинул ос- цилляционную гипотезу, согласно которой двойные связи в молекуле не фиксированы, а непрерывно перемещаются (осциллируют) между двумя возможными положениями:
Правильно отображая некоторые свойства бензола, формула Кекуле тем не менее не согласовывалась с рядом установленных фактов. Все это возвращало химиков к пересмотру структуры бензола. В соответствии с современными представлениями, основанными на данных квантовой химии и физико-химических исследований, молекула бензола представляет собой правильный плоский шестиугольник. Все углеродные атомы находятся в состоянии sp2-гибридизации. За счет sp2-гибридизованных атомных орбиталей каждый атом углерода образует три σ-связи (одну с атомом водорода и две с соседними атомами углерода). Негибридизованная р-атомная орбиталь участвует в образовании ароматического секстета. Облака р-электронов имеют форму объемной восьмерки и расположены перпендикулярно плоскости цикла, которая разделяет их пополам.
Если посмотреть на проекцию π-электронной плотности сверху, то мы можем увидеть такую картину:
Образование замкнутой сопряженной системы (ароматического секстета) является для молекулы бензола энергетически выгодным. Экспериметально установлено, что сопряжение в цикле приводит к уменьшению энергии на 150.7 кДж/моль, по сравнению с рассчитанной для циклогексатриена. Эта разность составляет энергию сопряжения. В бензольном кольце нет простых и двойных связей в прямом понимании этого слова. Такую связь называют ароматической. Если длина простой связи С—С в алканах составляет 0,154 нм, длина двойной связи в алкенах — 0,134 нм, то длина С—С связи в молекуле бензола равна 0,140 нм, т. е. является промежуточной между длиной одинарной и двойной связи. Совокупность специфических свойств бензола — высокая стабильность, инертность в реакциях присоединения, склонность к реакциям замещения, получила общее название «ароматичность», или «ароматические свойства». Что же требуется для того, чтобы мы имели право отнести соединение к ароматическому ряду? а) для проявления ароматического характера молекула должна прежде всего иметь плоское строение; б) молекула должна иметь замкнутую сопряженную систему; в) количество π-электронов должно соответствовать формуле 4n + 2, где п = 0, 1, 2, 3 и т. д. (данная закономерность была сформулирована в 1931 г. немецким ученым Э. Хюккелем). Номенклатура и изомерия По заместительной номенклатуре ИЮПАК одноядерные арены рассматривают как производные бензола.
При наличии в кольце двух и более заместителей их положение указывают цифрами. Нумерацию атомов углерода бензольного кольца осуществляют таким образом, чтобы заместители имели возможно меньшие номера. В дизамещенных производных бензола наряду с цифровым обозначением положений заместителей применяют приставки: орто (о-) положение - 1,2; мета (м-) положение - 1,3 и пара (п-) положение - 1,4.
Кроме названий по заместительной номенклатуре сохранились и тривиальные названия: толуол, ксилол, кумол и др. Одновалентные радикалы аренов имеют общее название—арилы (Аг). Двухвалентные радикалы бензола называют фениленами (о-, м-, п-). Изомерия гомологов бензола обусловлена разными структурами, числом и положением заместителей в бензольном кольце.
Для однозамещенных гомологов бензола характерна изомерия, связанная с разной структурой заместителя.
Дизамещенные производные бензола существуют в трех изомерных формах, в зависимости от взаимного расположения в бензольном кольце (изомеры положения).
Для тризамешенных бензолов с одинаковыми заместителями в бензольном кольце существуют также три изомера:
Способы получения аренов 1. Циклотримеризация аминов Ацетилен пропускают над активированным углем при повышенной температуре. Реакция была открыта Зелинским.
2. Обработка ацетона конц. H2S04
3. Дегидрогенизация алициклических соединений
Эта реакция показывает взаимосвязь между ароматическими и али- ииклическими соединениями. 4. Реакция Вюрца — Фиттига
Эта реакция чаще всего используется для получения гомологов бензола. 5. Алкилирование ароматических углеводородов по Фриделю — Крафтсу.
Физические свойства Бензол и его низшие гомологи представляют собой жидкости, обладающие специфическим запахом. Ароматические углеводороды не растворимы в воде и хорошо растворяются в органических растворителях. Многие из них сами являются хорошими растворителями для других органических веществ. Из-за высокого содержания углерода горят коптящим пламенем. Химические свойства Реакционная способность бензола и его гомологов определяется главным образом наличием в структуре замкнутой π-электронной системы, которая является областью повышенной электронной плотности. Ароматические углеводороды, как и алкены, обладают нуклеофильным характером. Однако, в отличие от ненасыщенных соединений, при взаимодействии с электрофильными реагентами арены более склонны к реакциям замещения, а не присоединения, поскольку при этом сохраняется их ароматический характер. Эти реакции носят название реакций электрофильного замещения SE. Реакции присоединения для аренов менее характерны, так как они приводят к нарушению ароматичности, с трудом вступают ароматические углеводороды и в реакции оксиления. 1. Реакции электрофильного замещения (SE) При атаке электрофильной частицей π-электронной системы бензольного кольца в результате электростатического взаимодействия образуется неустойчивый π-комплекс:
Далее электрофил «вырывает» пару электронов из ароматического секстета бензольного ядра и между ним и одним из атомов углерода образуется σ-связь. Таким образом нарушается ароматичность бензольного ядра, образуется карбкатион — σ-комплекс. Делокализаиию положительного заряда в σ-комплексе можно представить с помощью резонансных структур (I—111):
Образование σ-комплекса является наиболее высокоэнергетичной стадией реакции, определяющей ее скорость. σ-Комплекс не устойчив, он отщепляет протон от атома углерода, связанного с электрофилом, благодаря чему восстанавливается ароматичность бензольного кольца.
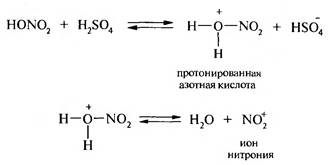
К наиболее важным реакциям SE относятся реакции нитрования, сульфирования, галогенирования, алкилирования и ацилирования. 1. Нитрование. В качестве нитрующих агентов чаше используют концентрированную азотную кислоту или смесь концентрированной азотной и серной кислот (нитрующая смесь):
Атакующей электрофильной частицей в реакции является ион нит- рония N02+, который образуется в результате кислотно-основного взаимодействия между азотной и серной кислотами, где азотная кислота играет роль основания:
Ион нитрония атакует π-электронную систему бензольного ядра. В результате реакции образуется нитробезол.
2. Сульфирование — это процесс замещения атома водорода в бензольном ядре на сульфогруппу — S03H. Для сульфирования бензола и его гомологов применяют концентрированную серную кислоту или олеум (раствор триоксида серы S03 в серной кислоте):
Особенности механизма сульфирования аренов изучены недостаточно. Однако экспериментальные данные свидетельствую о том. что атакующей электрофильной частицей служит триоксид серы SO3
3. Галогенирование. Бензол и его гомологи хлорируются, бромиру- ются и йодируются. Замещение атома водорода в бензольном ядре на атом хлора или брома осуществляют в присутствии катализаторов — кислот Льюиса (AlCl3, FeBr3, ZnCl2 и др.):
Под действием катализатора молекула галогена поляризуется. Атакующей электрофильной частицей служит либо комплекс поляризованной молекулы галогена с кислотой Льюиса, либо катион галогена, образующийся в процессе ионизации данного комплекса:
4. Алкилирование по Фриделю — Крафтсу. Для введения алкильной группы в молекулу ароматического соединения в качестве электро- фильных реагентов чаше всего используют галогеналканы. Взаимодействие происходит в присутствии катализаторов — кислот Льюиса:
Атакующей электрофильной частицей является карбкатион, который образуется при взаимодействии алкилирующего агента и катализатора:
Для алкилирования аренов также могут быть использованы спирты (реакции протекают в присутствии кислот Льюиса или минеральных кислот — H3P04, H2S04) или алкены (в этом случае алкилирование требует присутствия кислот Льюиса и минеральной кислоты как источника протонов). По своему механизму реакция алкилирования аналогична реакциям нитрования, сульфирования и галогенирования. 5. Ацилирование по Фриделю — Крафтсу. Ацилированием называют процесс введения в молекулу органического соединения ацильной группы Ацилирование бензола и его гомологов обычно осуществляют га- логенангидридами карбоновых кислот в присутствии кислот Льюиса:
Электрофилом, атакующим бензольное кольцо, является либо ацилиевый ион
Для введения ацильной группы могут быть использованы и ангидриды карбоновых кислот. II.Реакции присоединения Реакции присоединения не характерны для аренов, они протекают в жестких условиях. /. Гидрирование. При повышенных температуре и давлении, в присутствии катализаторов (мелкопористый никель — никель Ренея) бензол и его гомологи присоединяют три молекулы водорода:
Остановить реакцию на стадии образования продуктов частичного гидрирования невозможно, поскольку они гидрируются значительно легче, чем сам бензол. 2. Хлорирование. При интенсивном солнечном освещении или под действием ультрафиолетового излучения бензол присоединяет хлор. Реакция протекает по радикальному механизму с образованием гек- сахлорциклогексана:
III.Реакции окисления 1. Окисление бензольного цикла. Бензольное кольцо устойчиво к действию окислителей. В обычных условиях ни перманганат калия, ни азотная кислота, ни оксид хрома (VI), ни другие сильные окислители не окисляют бензол. В жестких же условиях, например, при действии кислорода воздуха в присутствии оксида ванадия (V205), при температуре 400-500 °С бензольное ядро окисляется, образуя малеиновый ангидрид:
2. Окисление гомологов бензола. Алкилбензолы, в отличие от незамещенного бензола, окисляются значительно легче. В этом случае при действии сильных окислителей (КМп04, К2Сг207 и др.) подвергаются окислению боковые цепи:
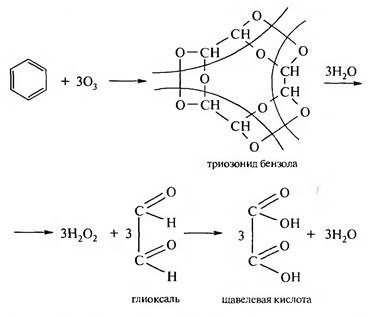
Продуктами реакции являются ароматические карбоновые кислоты. Каждый алкильный радикал в бензольном кольце, независимо от длины углеродной цепи, окисляется до карбоксильной группы. 3. Озонирование. Подобно алкенам, бензол и его гомологи реагируют с озоном, образуя продукты присоединения, — триозониды:
Триозониды взрывоопасны. Это маслянистые жидкости, они нестойкие и под действием влаги разрушаются с образованием дикарбонильных соединений и продуктов их дальнейшего окисления — дикарбоновых кислот. Правила ориентации в бензольном ядре В молекуле незамещенного бензола электронная плотность распределена равномерно, поэтому электрофильный реагент может атаковать в равной степени любой из шести атомов углерода. Если же в бензольном кольце содержится какой-либо заместитель, то под его влиянием происходит перераспределение π-электронной плотности и новый заместитель вступает в определенные положения по отношению к имеющемуся. По влиянию на направление реакций электрофильного замещения и реакционную способность бензольного кольца заместители можно разделить на две группы — заместители I рода (орто-, пара-ориентанты) и заместители II рода (мета-ориентанты). Заместители I рода — атомы и атомные группы, проявляющие положительный индуктивный (+/) или положительный мезомерный (+М)эффекты (доноры электронов):
Заместители 1 рода (за исключением галогенов) увеличивают электронную плотность в бензольном кольце, тем самым активируют его в реакциях SЕ и направляют следующие заместители в орто- и пара- положения.
Заместители II рода — группы, проявляющие отрицательный индуктивный (-1) или отрицательный мезомерный (-М) эффекты (элек- троноакцепторы):
Заместители II рода уменьшают электронную плотность в бензольном ядре и снижают скорость реакций SE по сравнению с незамещенным бензолом. Вновь входящий заместитель направляется преимущественно в мета-положение.
При введении третьего заместителя необходимо учитывать природу двух уже имеющихся в бензольном ядре. 12 |



























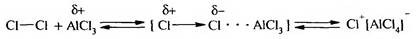


 .
.
 , либо комплекс ацилгалогенида с катализатором
, либо комплекс ацилгалогенида с катализатором