 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Растворы, реактивы, аппаратура.
1. Стандартный раствор a-аланина, 0,5 мг/мл 2. Стандартный раствор аспарагиновой кислоты, 0,5 мг/мл 3. Раствор нингидрина 0,25% в водонасыщенном н-бутиловом спирте 4. Подвижная фаза – н-бутанола, ледяной уксусной кислоты и воды в объемном соотношении (4:1:5) 5. Хроматографическая бумага № 1 или № 2 6. Капилляры стеклянные 7. Хроматографическая камера Выполнение работы 1. На предварительно подготовленной хроматографической бумаге простым карандашом намечают контуры «фитиля» длиной 40 мм и шириной 4 мм (см. рис.2). 2. На центр бумаги с помощью капилляра наносят каплю раствора разделяемой смеси. Раствор наносят в несколько приемов, чтобы впитывание происходило за счет капиллярных сил бумаги. Образовавшееся пятно осторожно обводят простым карандашом, т.е. фиксируют его положение на бумаге. Бумагу высушивают, вырезают «фитиль», как показано на схеме. 3. В хроматографическую камеру помещают кристаллизатор и тигель с 10 мл подвижной фазы. На кристаллизатор сверху помещают круг бумаги, следя за тем, чтобы «фитиль» был погружен в растворитель, и закрывают камеру крышкой. Во время разделения не рекомендуется открывать крышку камеры, перемещать камеру. 3. Когда произойдет размывание первичного пятна растворителем, и фронт ПФ пройдет расстояние, не доходя до края бумаги, бумагу вынимают, отмечают карандашом границы фронта растворителя, высушивают в токе теплого воздуха и приступают к проявлению зон. 4. Для проявления зон локализации аспарагиновой кислоты и a-аланина бумагу опрыскивают проявителем из стеклянного пульверизатора. Из появляющихся двух кольцевых окрашенных зон локализации первая принадлежит аспарагиновой кислоте, вторая – a-аланину. 5. Рассчитывают для обеих аминокислот значения Rf , считая началом их пути наружную границу первоначального пятна, отмеченную карандашом, а концом пути – наружные границы появившихся после проявления кольцевых зон локализации. Расстояние же, пройденное фронтом растворителя, мм, отсчитывают от центра хроматограммы (центра бумажного круга). 6. Рассчитывают коээфициент разделения a как отношение подвижностей Rf и оценивают степень разделения аминокислот. ЛИТЕРАТУРА 1. Васильев В. П. Аналитическая химия. Ч. 2– М.: Дрофа, 2007. 384 с. 2. Основы аналитической химии. 2 кн. /Под ред. Ю. А. Золотова.– М.: Высшая школа, 2004. –359 с. (кн.1), 503 с. (кн.2) 3. Ю.Я.Харитонов. Аналитическая химия. Аналитика. т. 1, 2.– М.: Высшая школа, 2001.– 615 с., 559 с. 4. Аналитическая химия. в 3-х т. /под ред. Л. Н. Москвина. – М.: Академия, 2008. Т. 1– 576 с., Т. 2– 304 с. 5. Кристиан Г. Аналитическая химия: в 2 т.: пер. с англ. – М.: БИНОМ, 2009.– Т. 1. 623 с Т. 2. 504 с. 6. Отто М. Современные методы аналитической химии.– М.: Техносфера, 2008.– 543 с. 7. Васильев В. П. Аналитическая химия: лабораторный практикум / В. П. Васильев, Р. П. Морозова, Л. А. Кочергина.– 3-е изд., стер.– М. : Дрофа, 2006.– 414 с. 8. Аналитическая химия и физико-химические методы анализа/Под ред. О.М.Петрухина. – М.: Химия, 2001. – 496 с. 9. Основы аналитической химии.Практическое руководство. Под ред.Ю.А.Золотова. – М.: Химия, 2001.– 463 с. 10. Гольберт К. А. Вигдергауз М. С. Введение в газовую хроматографию.– М.: Химия, 1990. – 351 с. 11. Столяров Б. В. Руководство к практическим работам по газовой хроматографии: учебное пособие / Б. В. Столяров, И. М. Савинов, А. Г. Витенберг.– Л.: Химия, 1988.– 335 с. 12. Аналитическая хроматография / К. И. Сакодынский, В. В. Бражников, С. А. Волков и др.– М.: Химия, 1993.– 463 с.: 13. Айвазов Б.В. Введение в хроматографию. – М.: Высшая школа, 1983. – 250с. 14. Вяхирев Д.А., Шушунова А.Ф. Руководство по газовой хроматографии. – М.: Высшая школа, 1987. – 335с. 15. Дорохова Е. Н., Прохорова Т.В. Аналитическая химия. Физико- химические методы анализа. – М.: Высшая школа, 1991. – 256с. ПРИЛОЖЕНИЕ 1 РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ Газовая хроматография Задача №1.Определить массовую долю (%) метана и этана в газовой смеси, если площади хроматографических пиков и поправочные коэффициенты этих компонентов равны, соответственно: 80 мм2 и 1.23 мм2, 40 мм2 и 1.15 мм2. Решение.Массовую долю компонента
Тогда,
Следует заметить, что при правильном расчете суммарное содержание определяемых компонентов в газовой смеси составляет 100%:
Задача №2.Реакционную массу 12.7500 г после нитрования толуола проанализировали методом газо-жидкостной хроматографии с применением этилбензола в качестве внутреннего стандарта в количестве 1.2500 г. Определить массовую долю (%) непрореагировавшего толуола по следующим данным:
Решение.В методе внутреннего стандарта массовую долю компонента (
где Тогда, Задача №3.Рассчитать время удерживания и удерживаемый объем компонента, элюирующегося из колонки, имеющей 200 теоретических тарелок, при скорости движения диаграммной ленты 720 мм/ч, если полуширина хроматографического пика составляет 3 мм. Объемная скорость газа-носителя равна 30 мл/мин. Решение:1. Число т.т. (N) связано с полушириной хроматографического пика (
2. Рассчитаем время удерживания 3. Зная объемную скорость газа-носителя ( Ионообменная хроматография Задача №1.Через колонку с катионитом в Н+ – форме пропустили 20,00 мл раствора KCl. Элюат оттитровали 15,00 мл 0.1 М раствора NaOH. Определить содержание KCl в анализируемом растворе. Решение.При пропускании через катионит в Н+ – форме раствора KCl в результате ионообменной реакции
Задача №2.Какая масса Со(2+) останется в растворе, если через колонку, заполненную 5 г катионита в Н+ – форме, пропустили 200,0 мл 0,1 н раствора CoCl2. Полная динамическая емкость катионита равна 1,60 мэкв/г. Решение.1. Рассчитаем количество миллимоль эквивалентов Со2+ – ионов, пропущенных через колонку с катионитом:
2. Количество миллимоль эквивалентов Со2+ – ионов, поглощенных 5 г катионита вычисляем из формулы:
3. Количество миллимоль эквивалентов Со2+ – ионов, оставшихся в растворе, равно: 4. Масса Со2+ – ионов, оставшихся в растворе, составляет:
Задача №3.Для определения полной динамической емкости (ПДОЕ) катионита через колонку с 5 г катионита в Н+ – форме пропустили 350,0 мл 0.05 н раствора CaCl2. При определении Са(2+) в элюате в порциях по 50,00 мл были получены следующие значения концентраций: 0,0030; 0,0080; 0,0150; 0,0250; 0,0400; 0,0500 и 0,0500 моль экв/л. Определить ПДОЕ катионита по кальцию. Решение.1. Вычислим количество миллимоль эквивалентов Са2+ – ионов, пропущенных через катионит: 2. Рассчитаем количество миллимоль эквивалентов Са2+ – ионов, содержащихся в элюате:
4. Полная динамическая емкость катионита составляет:
Плоскостная хроматография Задача №1.При идентификации аминокислот в концентрате из белкового гидролизата фронт растворителя (смесь н-бутанола, уксусной кислоты и воды) переместился от центра хроматографической бумаги на 55 мм. После опрыскивания хроматограммы раствором нингидрина получили три синих концентрических кольца с центрами, удаленными от стартовой линии на 20, 25 и 45 мм. В идентичных условиях хроматографировали растворы аминокислот и получили следующие коэффициенты подвижности: аспарагиновая кислота – 0,24, глутаминовая кислота – 0,36, лизин – 0,46, валин – 0,64, аланин – 0,82, тирозин – 0,90. Какие аминокислоты содержатся в концентрате из белкового гидролизата? Решение. 1. Вычислим значения Rf для компонентов смеси:
где li – расстояние от стартовой линии до центра пятна, L – расстояние, пройденное растворителем от стартовой линии до границы фронта растворителя.
3. Сравним рассчитанные значения Rf с величинами, полученными для аминокислот. Наиболее близкие значения соответствуют глутаминовой кислоте, лизину и аланину. Задача № 2.При разделении смеси бензойной (1) и пара-аминобензойной кислот (2) методом хроматографии в тонком слое в потоке смеси гексана и ацетона установлены значения подвижностей Rf , равные 0,54 и 0,30, соответственно. Вычислить относительные значения коэффициентов подвижности обеих кислот, если для стандарта – орто-хлорбензойной кислоты – Rf = 0,48. Решение. Относительный коэффициент подвижности вычисляют по формуле:
ПРИЛОЖЕНИЕ 2 Способы выражения концентрации Основная задача химического анализа – определение количества вещества. За единицу количества вещества принят моль. × 1моль вещества содержит 6,02×1023 условных частиц (например, атомов). В количественном анализе используется и дольная единица – миллимоль (моль), 1моль = 10-3 моль. Концентрация раствора (c) – это отношение количества растворенного вещества (А) к объему раствора (V). Другими словами, c(А) показывает количество вещества в единице объема раствора. В системе СИ основной единицей выражения концентрации растворов является молярная концентрации (моль/м3), на практике – моль/дм3, допускается моль/л. Молярная концентрация c(А), cм – это количество моль вещества А, содержащегося в 1 л раствора: см = m×1000/М×V, где m –масса вещества, г; М – относительная молекулярная (молярная) масса вещества, г/моль; V – объем раствора, мл. При этом используют следующие формы записи: например, 0,1 М HCl, или с(НСl) =0,1 моль/л = 0,1 ммоль/мл. Молярная концентрация эквивалента сн– это количество моль эквивалентов вещества, находящихся в 1 л раствора. При этом применяют такие формы записи: например, 0,1 н H2SO4, с(H2SO4) = 0,1 моль экв/л = 0,1 мэкв/мл; с(1/2 H2SO4) = 0,1 моль/л, где 1/2 – фактор эквивалентности (f). Если f=1, то предпочтительнее использовать термин «молярная» концентрация. Эквивалентом называется такая часть атома, иона или молекулы, которая химически равноценна (эквивалентна) одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции. Единицей количества эквивалента вещества является моль. Например, в реакции
эквивалент серной кислоты будет равен 1/2H2SO4,где 1/2 – фактор эквивалентности. Фактор эквивалентности (f) – это число, показывающее, какая часть моля вещества равноценна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции. Фактор эквивалентности может быть равен 1 или меньше 1, например, f (NH4OH)=1; f (H2SO4 )=1/2; f(KMnO4)= 1/5 и т. д. Для нахождения фактора эквивалентности вещества обязательно надо указывать реакцию, в которой данное вещество участвует. В реакциях кислотно-основного взаимодействия фактор эквивалентности равен f=1/[H+], где [H+] – число ионов водорода, отдаваемое или присоединяемое одной молекулой или одним ионом. Для нахождения f в окислительно-восстановительной реакции составляют полуреакции и вычисляют его значение по формуле f = 1/z, где z – число электронов, отдаваемое или присоединяемое одной молекулой или одним ионом в данной полуреакции. Например, в полуреакции Молярной массой эквивалента вещества (Мэ) называют массу одного моль эквивалента этого вещества, равную произведению фактора эквивалентности на молярную массу вещества (М). Например: Мэ(H2SO4) = f(H2SO4 )×M(H2SO4 )=1/2×98= 49 г/моль-экв; Мэ(H2SO4) – молярная масса эквивалента серной кислоты. Молярная концентрация эквивалента вычисляется по формуле
Взаимосвязь между молярной концентрацией и молярной концентрацией эквивалента отражена в следующей формуле
Массовая концентрация – это отношение массы растворенного вещества к объему раствора. Численное значение этой концентрации выражается в г/л, мг/мл, г/мл. В титриметрическом анализе применяют единицу измерения массовой концентрации в г/мл. Это титр раствора, Т. Например, Т(HNO3)=0,01232 г/мл: Т = m/V Титр рабочего раствора по определяемому веществу, Т(В/А), г/мл – это отношение массы m(А) определяемого вещества к эквивалентномуобъему V(В) рабочего раствора: T(B/A)=m(А)/V(В) Другими словами, Т(В/А) показывает, какая масса анализируемого вещества (А) реагирует с 1 мл рабочего раствора вещества (В). Зная Т(В/А) и объем (мл) рабочего раствора (В), затраченного на титрование, можно рассчитать массу (г) определяемого вещества: m(А) = Т(В/А) V(В) Например, m(Na2CO3)=T(HCI/ Na2CO3)×V(HCI). Кроме того, Т(В/А) = сн(В)×Мэ(А)/1000 Массовая доля w(А) вещества А – это отношение массы m(А) вещества А к общей массе mобщраствора или смеси веществ: w(А)= m(А) / mобщ В количественном анализе массовую долю измеряют в процентах. Она характеризует содержание компонента в твердом веществе или растворе: w(А) = [m (А)/ mобщ]×100(%) При этом возможны, например, следующие варианты употребления терминов: реактив чистотой 98 % (по массе); соль, содержащая по массе 3,1 % примесей, минерал с массовой долей SiO2 8,4 %, w(SiO2)=8,4%; раствор плотностью 1,28 г/см3 с массовой долейH2SO437 % или w(H2SO4)=37 %.Это означает, что 37 г серной кислоты содержится в 100 г раствора, плотность которого равна 1,28 г/см3. В справочных таблицах приведены для растворов кислот, оснований и некоторых солей соответствующие значения плотностей этих растворов (r в г/см3) и массовые доли (w %) веществ. Используя эти величины, можно рассчитать молярную концентрацию эквивалента или массовую концентрацию вещества в растворе. Пример 1. В 45,0 мл воды растворили 5,0 г КOH. Вычислить массовую долю растворенного компонента. Решение: воспользуемся приведенной выше формулой: w = 5×100/(5 + 45) =10 % Масса полученного раствора равна 50,0 г, т. к. плотность воды при комнатной температуре равна 1,0 г/см3. Взаимосвязь между молярной концентрацией, молярной концентрацией эквивалента и массовой долей растворенного компонента и титром приводится в формулах, приведенных в таблице. Таблица Формулы пересчета концентраций растворов
При переходе от массовой доли растворенного компонента к молярной или молярной концентрации эквивалента необходимо учитывать плотность раствора. Между массой вещества (m), его плотностью (r) и объемом (V) существует следующее соотношение: r = m/V. В справочных таблицах для растворов кислот, оснований и некоторых солей приведены массовые доли веществ (w, %) и соответствующие значения плотностей этих растворов (r, г/см3). Используя эти величины, можно рассчитать молярную, молярную концентрацию эквивалента или массовую концентрацию раствора. ПРИЛОЖЕНИЕ 3 Расчеты при приготовлении растворов Стандартные растворы. В титриметрическом анализе растворы с точно известной концентрацией называют рабочими, или стандартными. Их можно приготовить несколькими способами: а) по точной навеске исходного вещества; б) по приблизительной навеске вещества с последующим определением точной концентрации (стандартизацией) приготовленного раствора по соответствующему стандартному раствору; в) по фиксаналу. В первом способе в качестве исходных веществ для приготовления раствора можно применять только химически чистые, устойчивые соединения, состав которых строго соответствует химической формуле. Такие вещества называют установочными, или первичными стандартами. Стандартные растворы из таких веществ приготавливают растворением точной навески в воде и разбавлением полученного раствора до требуемого объема. Зная массу (m) растворенного в воде химически чистого соединения и объем (V) раствора, легко вычислить титр (Т) и молярную концентрацию эквивалента ( Сн) приготовленного раствора: Второй способ основан на приготовлении растворов из веществ, не удовлетворяющих перечисленным выше требованиям. В этом случае сначала готовят раствор приблизительной концентрации по навеске вещества, взятой на технических весах. Параллельно с этим готовят стандартный раствор какого-либо подходящего установочного вещества (первичный стандарт). Далее первичный стандарт титруют раствором , приготовленным по приблизительной навеске, и, зная концентрацию стандартного раствора Сн(А) вычисляют концентрацию приготовленного раствора Сн(В) ( формулы 3, 4). Титрованные растворы, концентрацию которых находят в результате титрования, называются стандартизованными (или титрованными) растворами (или вторичными стандартами), а установление точной концентрации раствора титрованием называют стандартизацией раствора.
Приготовление стандартного раствора изфиксанала сводится к тому, чтобы количественно перенести содержание ампулы, в которую запаяно точно дозированное количество или различных твердых веществ, или растворов известной концентрации в мерную колбу определенной емкости (чаще всего 1 л), после чего растворить вещество в дистиллированной воде и полученный раствор разбавить водой до метки. Приготовление растворов из концентрированных растворов разбавлением.При приготовлении растворов (например, кислот и оснований) используется разбавление. В этом случае исходят из того, что при разбавлении раствора его объем и концентрация будут изменяться, а общее количество моль или моль эквивалентов растворенного вещества останется постоянным. Поэтому при разбавлении раствора справедливо равенство:
Следовательно, зная молярную или нормальную концентрацию концентрированного раствора, можно вычислить его объем, необходимый для приготовления разбавленного раствора заданного объема и заданной концентрации. Пример 1. Сколько миллилитров конц. H2SO4 (ρ=1,49 г/см3), содержащей 60% H2SO4, нужно взять для приготовления 500 мл0,1 н. раствора? Решение: 1. Вычислим молярную концентрацию эквивалента концентрированной H2SO4:
2. Если раствор разбавлять, то его объем и концентрация будут изменяться, но общее количество эквивалентов растворенного вещества останется постоянным. Поэтому при разбавлении, как и при титровании, справедливо равенство: Пример 2. Рассчитать, какой объем 3 н H2SO4 следует прибавить к 1 л 0,6 нH2SO4, чтобы получить 1,5 н раствор? Решение:
Решив полученное уравнение, получим V=600 мл. ПРИЛОЖЕНИЕ 4 Расчеты при определении результатов титриметрического анализа Химические элементы и их соединения реагируют между собой в строго определенных массовых количествах, соответствующих их химическим эквивалентам. Для двух стехиометрически реагирующих веществ справедливо соотношение:
Соотношение (6) представляет собой следствие закона эквивалентов и является основным расчетным уравнением титриметрического анализа. Метод отдельных навесок. При титриметрическом определении этим методом навеску вещества растворяют в небольшом произвольном объеме растворителя и проводят титрование всего раствора. Зная объем, V(В), и нормальную концентрацию рабочего раствора, СН(В), израсходованного на реакцию взаимодействия с определяемым веществом, можно определить содержание определяемого компонента m(A) по формуле:
Метод пипетирования. Обычно в титриметрическом анализе навеску анализируемого вещества растворяют в мерной колбе определенного объема (Vобщ.) и для титрования берут не весь раствор, а только часть его (Va), аликвоту. Поэтому формула для расчета массы определяемого вещества имеет вид:
Для нахождения процентного содержания следует учесть массу навески m:
Пример. Навеску 0,1936 г железной руды перевели в раствор, восстановили железо до Fe(II) идовели объем раствора до 100 мл. Вычислить массовую долю Fe(II) в руде, если на титрование 10 мл полученного раствора в кислой среде израсходовано 8,75 мл 0,02н раствора K2Cr2O7. Решение. При титровании железа (П) раствором K2Cr2O7 в кислой среде протекает окислительно-восстановительная реакция, которая в ионном виде выглядит следующим образом: 6Fe2+ + Cr2O72– + 14H+ С учетом полуреакции Fe2+ – 1e ® Fe3+ находим фактор эквивалентности f(Fe2+ ) = 1 и вычисляем молярную массу эквивалента железа:
Мэ(Fe2+ ) =f ∙М(Fe2+ ) = 55,85 × 1 = 55,85 г/моль- экв
Затем рассчитываем массу железа (П) в растворе и процентное содержание железа в руде:
Способы титрования В титриметрическом анализе различают прямое, обратное и косвенное титрование. Прямое титрование. Прямое титрование основано на том, что к определенному объему определяемого компонента по каплям приливают из бюретки стандартный раствор реагента (титранта). Окончание реакции узнают по изменению окраски индикатора или другим способом. Зная концентрацию раствора титранта и его количество, израсходованное на реакцию с определяемым веществом, можно легко вычислить содержание вещества (формулы 7,8). Обратное титрование.Этот прием состоит в том, что к определенному объему раствора определяемого компонента приливают точно измеренный объем стандартного раствора D, взятый в избытке. Избыток не вошедшего в реакцию стандартного раствора D оттитровывают стандартным раствором B(титрантом).
Пример 2. При определении содержания CaO в образце мела навеску в 0,1500 г обработали 50,00 мл 0,0999 М HCI, остаток кислоты оттитровали 10,00 мл NaOH (K=1,01). Вычислить массовую долю CaO в образце мела. Решение: CaO + изб. 2HCI = CaCI2 +H2O +ост. HCI ост. HCI + NaOH = NaCl + H2O Из условия задачи видно, что определение CaO проводилось методом обратного титрования. Поэтому для расчета массы CaO в образце мела выбираем формулу (6.3.3):
Косвенное титрование. В некоторых случаях прибегают к особому приему титрования, называемому косвенным, или титрованием заместителя. Сущность его заключается в том, что к определенному объему анализируемого раствора прибавляют какой-либо вспомогательный реагент, реагирующий с определяемым компонентом с выделением эквивалентного количества нового вещества (заместителя), которое оттитровывают раствором титранта. Например, K2Cr2O7определяют путем добавления к его раствору KI и H2SO4 . Выделившийся в результате реакции I2 (заместитель)титруют раствором титранта Na2S2O3. При этом протекают следующие реакции:
Зная количество титранта Na2S2O3, израсходованное на реакцию с I2, количество которого эквивалентно количеству K2Cr2O7, нетрудно вычислить содержание дихромата калия в анализируемом растворе:
.
ОГЛАВЛЕНИЕ
ГЛАВА 1. ХРОМАТОГРАФИЯ.................................................................................................................................... 3 Введение........................................................................................................................................................................ 3 1. Сущность хроматографии................................................................................................................................... 4 2. Классификация хроматографических методов............................................................................................. 5 Вопросы для самоконтроля............................................................................................................................ 8 3. Ионообменная хроматография........................................................................................................................... 9 3.1. Обменная емкость ионитов........................................................................................................................ 10 3.2. Классификация ионитов............................................................................................................................. 11 3.3. Практическое применение ионообменной хроматографии............................................................. 12 Вопросы для самоконтроля.......................................................................................................................... 12 4. Плоскостная хроматография............................................................................................................................ 13 4.1. Тонкослойная хроматография................................................................................................................. 13 4.2. Бумажная хроматография......................................................................................................................... 16 Вопросы для самоконтроля.......................................................................................................................... 18 5. Газовая хроматография..................................................................................................................................... 18 5.1. Газотвердофазная хроматорафия........................................................................................................... 19 5.2. Газожидкостная хроматография............................................................................................................. 20 5.3. Аппаратурное оформление газовой хроматографии........................................................................ 21 5.3.1.Основные узлы газового хроматографа......................................................................................... 22 5.3.2. Детекторы............................................................................................................................................... 24 Вопросы для самоконтроля.......................................................................................................................... 25 5.4. Характеристики удерживания.................................................................................................................. 26 5. 5. Теоретические представления в газовой.............................................................................................. 28 хроматографии..................................................................................................................................................... 28 5.5.1. Теория эквивалентных теоретических тарелок........................................................................... 28 5.5.2. Кинетическая теория........................................................................................................................... 29 5.5.3. Оценка эффективности, селективности и разделительной....................................................... 31 способности хроматографических колонок............................................................................................ 31 Вопросы для самоконтроля.......................................................................................................................... 32 5.6. Качественный анализ................................................................................................................................. 32 5.7. Количественный анализ............................................................................................................................. 34 5.8. Практическое применение газовой хроматографии........................................................................... 36 Вопросы для самоконтроля.......................................................................................................................... 37 6. Жидкостная колоночная хроматография..................................................................................................... 38 6.1. Адсорбционная хроматография.............................................................................................................. 38 6.2. Распределительная хроматография....................................................................................................... 40 6.3. Эксклюзионная хроматография............................................................................................................... 41 6.4. Особенности жидкостных хроматографов........................................................................................... 42 Вопросы для самоконтроля.......................................................................................................................... 43 ЛИТЕРАТУРА............................................................................................................................................................ 64 ГЛАВА 2. ПРАКТИЧЕСКИЕ РАБОТЫ.................................................................................................................... 45 Газожидкостная хроматография............................................................................................................ 45 Работа 1. Определение качественного состава смеси на основе...................................................... 45 характеристик удерживания........................................................................................................................ 45 Характеристики удерживания.............................................................................................................................. 45 Работа 2. Определение количественного состава................................................................................. 48 многокомпонентной смеси............................................................................................................................ 48 Работа 3. Определение критериев разделения........................................................................................ 50 ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ........................................................................................................... 52 Работа 1. Определение содержания в растворе нейтральных солей............................................... 52 Работа 2. Определение динамической обменной емкости катионита............................................. 53 Работа 3. Определение ионов никеля и цинка в смеси.......................................................................... 55 с использованием разделения их на анионите........................................................................................ 55 ТОНКОСЛОЙНАЯ ХРОМАТОГРАФИЯ............................................................................................................ 56 Работа 1. Разделение и обнаружение галогенидов............................................................................... 56 БУМАЖНАЯ ХРОМАТОГРАФИЯ...................................................................................................................... 59 Работа 1. Разделение железа (III) и меди (II).......................................................................................... 59 Работа 2. Разделение смеси аминокислот................................................................................................ 61 ЛИТЕРАТУРА................................................................................................................................................................ 65 ПРИЛОЖЕНИЕ 1........................................................................................................................................................... 64 РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ............................................................................................................................. 65 Газовая хроматография................................................................................................................................. 65 Ионообменная хроматография.................................................................................................................... 66 Плоскостная хроматография....................................................................................................................... 68 ПРИЛОЖЕНИЕ 2........................................................................................................................................................... 69 СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ................................................................................................. 69 ПРИЛОЖЕНИЕ 3........................................................................................................................................................... 73 РАСЧЕТЫ ПРИ ПРИГОТОВЛЕНИИ РАСТВОРОВ......................................................................................... 73 ПРИЛОЖЕНИЕ 4........................................................................................................................................................... 75 РАСЧЕТЫ ПРИ ОПРЕДЕЛЕНИИ РЕЗУЛЬТАТОВ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА................... 75 ОГЛАВЛЕНИЕ............................................................................................................................................................... 78
Учебное издание
Татьяна Михайловна Гиндуллина Надежда Михайловна Дубова
|



 (%) в методе внутренней нормализации рассчитывают по формуле:
(%) в методе внутренней нормализации рассчитывают по формуле:
 .
. .
. .
. ) рассчитывают по формуле:
) рассчитывают по формуле:
 и
и  – поправочные коэффициенты определяемого компонента и внутреннего стандарта;
– поправочные коэффициенты определяемого компонента и внутреннего стандарта;  и
и  – площади хроматографических пиков определяемого компонента и внутреннего стандарта;
– площади хроматографических пиков определяемого компонента и внутреннего стандарта;  – масса внутреннего стандарта, г;
– масса внутреннего стандарта, г;  – масса анализируемой пробы, г.
– масса анализируемой пробы, г. .
. ) следующей формулой:
) следующей формулой: , т.е.
, т.е.  , откуда
, откуда 
 , зная скорость движения ленты самописца,
, зная скорость движения ленты самописца, 

 , т.е.
, т.е. 
 ), измеренную с помощью расходомера на выходе из колонки, можно вычислить удерживаемый объем компонента (
), измеренную с помощью расходомера на выходе из колонки, можно вычислить удерживаемый объем компонента (  ) по формуле:
) по формуле:  , т.е.
, т.е. 
 в элюате появляется соляная кислота, количество которой эквивалентно количеству соли, т.е.
в элюате появляется соляная кислота, количество которой эквивалентно количеству соли, т.е.  . При титровании кислоты раствором щелочи справедливо равенство:
. При титровании кислоты раствором щелочи справедливо равенство:  или
или  . Тогда, содержание KCl в анализируемом растворе рассчитывают следующим образом:
. Тогда, содержание KCl в анализируемом растворе рассчитывают следующим образом:







 ,т.е.
,т.е.  3. Количество миллимоль эквивалентов Са2+ – ионов, поглощенных катионитом, равно:
3. Количество миллимоль эквивалентов Са2+ – ионов, поглощенных катионитом, равно: 

 ,
,


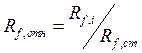 ,
,

 или
или
 f (I2 ) =1/2, а f (I– ) = 1.
f (I2 ) =1/2, а f (I– ) = 1.
 .
.














 или
или  (5)
(5) н
н . Применяя его к рассматриваемому случаю, получим:
. Применяя его к рассматриваемому случаю, получим:  , откуда Vконц(H2SO4)=3 мл.
, откуда Vконц(H2SO4)=3 мл.
 или
или  (6)
(6) ,(г) (7)
,(г) (7) , (г) (8)
, (г) (8) (9)
(9) 6Fe3+ + 2Cr3+ + 7H2O
6Fe3+ + 2Cr3+ + 7H2O г
г




