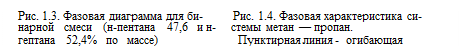ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Фазовые превращения углеводородных систем
Содержание
Введение ----------------------------------------------------------------------- 3 1. Фазовые превращения углеводородных систем ---------------------- 4 2. Критические параметры многокомпонентных углеводородных систем --------------------------------------------------------------------------------- 10 3. Фазовые состояния системы нефть—газ-------------------------------- 15 4. Газоконденсатная характеристика залежи------------------------------ 16 5. Методы расчета фазовых превращений-------------------------------- 17 Список использованной литературы------------------------------------- 28
Введение Нефть и газ по химическому составу являются очень сложными углеводородами, находящимися при повышенных пластовом давлении и температуре. При извлечении углеводородов на поверхность давление и температура пластовой смеси уменьшаются. Состояние смеси углеводородов на поверхности зависит от состава углеводородов, добываемых из скважины, и от давления и температуры, при которых они извлекаются. Углеводороды, остающиеся в пласте на любой стадии его истощения, претерпевают физические изменения, так как пластовое давление по мере отбора из пласта нефти или газа уменьшается. Отсюда возникает необходимость изучения физических свойств углеводородов, находящихся в природных условиях, и особенно изменений этих свойств в зависимости от давления и температуры. Знание физических закономерностей дает возможность оценить количество полученных газа и жидкости, приведенных к стандартным условиям, при добыче на поверхность единицы объема пластовой жидкости. Эти данные необходимы для оценки промышленных запасов нефти и газа в пласте. Из-за сложности природных углеводородных смесей очень часто приходится пользоваться эмпирическими данными, полученными в результате лабораторных исследовании. Химический состав углеводородных газов может быть легко определен до гептанов. Химический состав сырой нефти оценить труднее, так как она состоит в основном из более тяжелых углеводородов, чем гептаны. В этой главе обсуждаются основные принципы состояния углеводородов, а также лабораторные испытания и методы расчетов, применяемые при оценке физических свойств углеводородных смесей. Помимо свойств углеводородов, представляют интерес также свойства воды, каким-либо образом связанной с продуктивным пластом, так как вода занимает часть пространства пласта, создает энергию для добычи нефти, а также может добываться вместе с нефтью и газом. Для исследования физических свойств природных жидкостей и газов необходимо в первую очередь правильно понимать состояние и изменение простых систем. Однокомпонентные углеводороды в чистом виде не существуют в природе и могут быть получены только после тщательной переработки углеводородных смесей. Однако ввиду того, что физические свойства однокомпонентных углеводородов и их изменение в зависимости от давления и температуры качественно такие же, как и более сложных систем, можно пользоваться основными определениями и принципами термодинамики и физической химии, относящимися к индивидуальным углеводородам. Содержимое продуктивных пластов в основном находится в состоянии газа, пара или жидкости. Однако эти термины передают сущность состояния только при определенных давлениях и температурах. Вещество в зависимости от давления и температуры, при которых оно находится, может существовать в газообразном или жидком состоянии. Понятие «пар» определяется как газообразное состояние любого вещества, которое при обычных условиях является жидкостью или твердым телом. Под обычными условиями понимаются атмосферные условия давления и температуры. При рассмотрении углеводородов удобно понятия «газ» и «пар» считать синонимами. Углеводородные системы, как и другие системы, могут быть гомогенными или гетерогенными. В гомогенной системе все ее части имеют одинаковые физические и химические свойства. Для гетерогенной системы физические и химические свойства в разных точках различны. Гетерогенные системы состоят из фаз. «Фаза» по определению Даниельса — это «определенная часть системы, которая является гомогенной и физически отделена от других фаз отчетливыми границами». Например, в гетерогенной системе одновременно содержатся лед, вода и водяной пар. Степень дисперсности не определяет количества фаз, В приведенном примере лед независимо от того, существует он в виде одного куска или раздроблен на несколько частей, является одной фазой.
Фазовые превращения углеводородных систем В природе в зависимости от условий могут существовать углеводородные системы самого различного состава в виде газа, жидкости, твердого тела или их смесей. Для газоконденсатных месторождений характерны углеводородные системы, в основном состоящие из легких углеводородов и находящиеся при некоторых начальных давлениях и температуре в газообразном состоянии. Содержание более тяжелых углеводородов, существующих обычно (т.е. при рат и t = 20 —40° С) в виде жидкости, в большой степени зависит от давления и температуры, а также от состава системы, т. е. компонентов в нее входящих. Как правило, содержание тяжелых углеводородов возрастает с увеличением давления и температуры. Однако из этого не следует, что все глубоко залегающие пласты, поровое пространство которых насыщено газообразными углеводородами, при высоких давлениях и температурах должны содержать тяжелые компоненты. В реальных условиях существенную роль играет исходный материал, на базе которого формировалась залежь. При наличии соответствующего ряда углеводородов в процессе формирования залежи вероятность образования углеводородных систем, содержащих большое количество тяжелых фракций (в обычных условиях существующих в виде жидкости), с увеличением пластовой температуры и давления возрастает. Система углеводородов, существующая при высоких давлениях и температурах, в однофазном газообразном состоянии может иметь различный состав. Причем, чем выше давление и температура, тем большее количество тяжелых фракций может переходить в газообразное состояние. В свою очередь, в зависимости от состава системы углеводородов, существенно изменяется ее термодинамическая характеристика. При этом установлено, что чем больше компонентов входит в данную систему, тем труднее аналитически определить изменение ее параметров при различных давлениях и температуре. Поэтому начинать изучение углеводородных систем целесообразнее с наиболее простых, например индивидуальных углеводородов. Индивидуальные углеводороды могут находиться в парообразном (газовом), жидком и твердом состояниях. При некоторых определенных для данного вещества давлениях и температурах часть его может находиться в жидком (или твердом), а другая часть—в газообразном состояниях. Возможно равновесное состояние индивидуального вещества одновременно во всех трех фазах. Чтобы судить о том, при изменении каких независимых переменных (или параметров) возможно существование тех или иных фаз для индивидуального вещества (или системы), находящегося в равновесном состоянии, пользуются правилом, которое выражается уравнением 2+n-к =F, (1.1) где n—число компонентов; к—число фаз; F—число степеней свободы. Под степенями свободы подразумеваются такие независимые переменные, как температура, давление и состав фаз. Для систем, находящихся одновременно в двух- и трехфазном состоянии, концентрация компонентов не является независимой переменной, хотя концентрация в данной фазе — это переменная правила фаз. Индивидуальные вещества, находящиеся в трехфазном состоянии, не имеют степеней свободы. Это состояние выражается инвариантной тройной точкой на соответствующей диаграмме. Индивидуальные вещества, находящиеся в двухфазном состоянии (например, пар и жидкость), имеют одну степень свободы. Для определения всех свойств фаз достаточно задаться одним лишь значением температуры. Следует отметить, что этим правилом устанавливается только природа фаз, а не их соотношения. Двухкомпонентные системы, находящиеся в двухфазном состоянии, имеют две степени свободы, т. е. состояние такой системы будет определяться температурой и давлением. Для трехкомпонентной системы, существующей в виде двух фаз, число степеней свободы увеличивается до трех. Состояние такой системы определяется температурой, давлением и еще некоторым параметром, выражающим состав фаз, например концентрацией одного компонента в какой-либо фазе или отношением концентрации одного компонента к концентрации другого в той же фазе. Однако природный газ состоит из гораздо большего числа компонентов, а, следовательно, для определения состояния системы требуется знание большого числа параметров, например, концентраций компонентов в какой-либо фазе. Это требование исключает или делает весьма неудобным применение правила фаз. Соотношения фаз индивидуальных углеводородов в зависимости от давления, объема и температуры описываются на основании данных исследования пространственными кривыми в координатах pVТ. Но поскольку подобные графики сложны, предпочитают пользоваться более простыми, выражающими зависимость давления от температуры для некоторого постоянного удельного объема и давления от удельного объема для некоторой постоянной температуры (Рис. 1.1). Как видно из диаграмм, различие в фазах наблюдается не при всех температурах. При некоторой температуре (определенной для каждого индивидуального углеводорода) данный газ, как бы велико не было давление в системе, не может находиться в жидкой фазе. Такую температуру и давление, соответствующее ей, называют критическими. На фазовых диаграммах точка, соответствующая критическим температуре и давлению, называется критической точкой С (см. рис. 1.1). Критическая точка — это такое состояние давления и температуры, при котором свойства газообразной и жидкой фаз становятся одинаковыми.
В критической точке и закритической области вещество находится в однофазном состоянии и свойства жидкости и пара, например плотность, вязкость, становятся одинаковыми, а скрытая теплота испарения и поверхностное натяжение обращаются в нуль. Проследим за изменением удельного объема метана в зависимости от давления для какой-то определенной температуры ниже критической (рис. 1.2). При уменьшении объема давление возрастает (и, наоборот, при увеличении давления уменьшается объем). Но при некотором удельном объеме (давлении) появляется жидкая фаза. Начиная с этого момента, с уменьшением объема не происходит увеличение давления, и только тогда, когда все вещество перейдет в жидкое состояние, резко увеличится давление. Точки на диаграмме, в которых вещество начинает переходить в жидкую фазу, т. е. когда появляются первые капли сконденсировавшейся жидкости, называются точками росы (начала конденсации). Совокупность этих точек для различных температур дает линию точек росы (СВ на фазовой диаграмме рис. 1.2). Точки на диаграмме, в которых вещество полностью перешло в жидкость, называются точками кипения (кривая АС на диаграмме рис. 1.2). Обе линии сходятся в критической точке С. Как видно из диаграммы, чем выше температура, тем при большем давлении и меньшем удельном объеме появляется жидкая фаза. Наконец, при критической температуре жидкой фазы нет при любых давлениях. В пластовых условиях нефть может находиться либо в однофазном состоянии, когда газ полностью растворен в нефти, либо в двухфазном, когда некоторое количество газа находится над нефтью в свободном, нерастворенном состоянии, образуя газовую шапку. Наличие свободного газа в пласте до начала разработки месторождения определяется соотношением между жидкими и газообразными углеводородами в залежи, при котором существующее пластовое давление оказывается недостаточным для полного растворения газа и в пласте устанавливается термодинамическое равновесие, определяющее сосуществование двух фаз. В однофазном состоянии пластовая нефть может быть или полностью насыщена газом (малейшее снижение давления должно привести к образованию второй, т. е. газовой, фазы), или недонасыщена (для образования второй фазы необходимо более значительное снижение давления, соответствующее величине пережатия нефти). Существование пережатых пластовых нефтей определяется соотношением между жидкими и газообразными углеводородами в залежи, при котором растворение газа в нефти заканчивается на более низкой ступени давления, чем пластовое. Под степенью пережатия (недонасыщенности) пластовой нефти следует понимать разность между пластовыми давлениями и давлением насыщения. Степень пережатия (недонасыщенности) пластовых нефтей колеблется от 1—2 am до нескольких десятков атмосфер. В ряде случаев пережатие достигает 100 am и более. Степень насыщенности нефти газом характеризуется давлением насыщения. Под давлением насыщения пластовой нефти понимается давление, при котором начинается выделение из нефти первых пузырьков растворенного газа. При достижении этого давления газ из растворенного состояния начинает переходить в свободное. Для месторождения с газовой шапкой давление насыщения равно пластовому давлению на контуре нефть—газ. Для месторождения недонасыщенной нефти давление насыщения ниже пластового давления и является границей существования в пласте однофазной и двухфазной углеводородных систем. При разработке однофазных месторождений нефти, как только депрессия в пласте достигнет давления насыщения, начинается выделение из нефти газа. В этом случае давление насыщения в отдельные периоды разработки можно считать равным текущему пластовому давлению. Наибольший интерес представляет значение первоначального давления насыщения, так как именно эта величина характеризует переход однофазного потока нефти в пласте в двухфазный. В системе, представляющей смесь двух углеводородов (так называемой бинарной системе), при увеличении давления (при определенной температуре ниже критической) удельный объем уменьшается; при достижении точки росы удельный объем уменьшается лишь при заметном увеличении давления (рис. 1.3). В этом существенное отличие бинарных систем от индивидуальных углеводородов. Фазовая диаграмма для смеси двух углеводородов в координатах давление—температура также отличается от фазовых диаграмм индивидуальных углеводородов и имеет вид петли, внутренняя часть которой соответствует области существования двух фаз.
 На рис. 1.4 приведены фазовые диаграммы для смеси метан — пропан различных концентраций. Ширина петли на таких диаграммах будет тем больше, чем больше различаются температуры кипения компонентов смеси. Из этого следует, что фазовому состоянию смеси, в которой один из компонентов метан, соответствует диаграмма с более широкой петлей (в координатах давление—температура). Однако для смесей различных концентраций двух определенных компонентов петля будет тем уже, чем меньше содержание одного компонента в другом. И при одинаковых концентрациях компонентов в смеси ширина петли фазовой диаграммы для данной системы будет максимальной. Критическая температура смеси из двух компонентов будет в пределах критических температур компонентов в зависимости от состава смеси. Критическое же давление смеси существенно выше критических давлений входящих в нее индивидуальных компонентов. Причем, чем больше разница между точками кипения двух веществ, тем выше критическое давление бинарной системы. Более полно реальные углеводородные системы, типичные для газоконденсатных месторождений, можно иллюстрировать трехкомпонентными смесями, подобранными таким образом, чтобы один из компонентов соответствовал сухому газу, другой — промежуточным фракциям, а третий — тяжелому остатку. Из тройных и многокомпонентных систем хорошо изучены системы метан—пропан—пентан, метан—бутан—декан, бензин и др. В общем, их фазовые характеристики сходны с фазовыми характеристиками бинарных систем, но в то же время имеется и существенное различие. Для бинарных и многокомпонентных систем точка, в которой фазы становятся идентичными, не соответствует ни наивысшему давлению, ни наивысшей температуре, при которой могут существовать обе фазы. Интересно отметить, что вещество, находящееся в условиях, соответствующих или почти соответствующих критической точке, изменяет свой цвет. Это явление известно под названием критической опалесценции и объясняется, по-видимому, природой сил сцепления молекул, вызывающей рассеяние света. При некотором уменьшении давления от значения, соответствующего критическому, система окрашивается в красновато-коричневый цвет в проходящем свете или в светло-голубой цвет в отраженном свете. В небольших пределах изменения давления окраска некоторое время сохраняется в обеих фазах. Сравнительно более интенсивно окрашены смеси, содержащие высококипящие углеводороды. Интенсивность окраски наибольшая при критической температуре и может еще наблюдаться при температуре, отличающейся от критической на 17—22° С. Критическая точка С (рис. 1.5) находится в месте слияния линий точек росы и точек кипения, ограничивающих двухфазную область системы. Как видно из диаграммы, максимальная температура, при которой могут существовать две фазы, называемая крикондентермой Tм, выше критической температуры. Также и максимальное давление pм выше критического.
В системе, фазовое состояние которой иллюстрируется диаграммой на рис. 1.5, могут происходить обратные испарение и конденсация. На диаграмме можно выделить две такие области: заштрихованная часть выше прямой АС и заштрихованная часть правее прямой СВ. В самом деле, если мы при каком-то произвольном давлении р, выбранном в пределах рс < р < pм будем повышать температуру системы, то появится газовая фаза. Мы будем наблюдать прямое испарение. Однако при дальнейшем повышении температуры (в заштрихованной области) газовая фаза будет уменьшаться, т. е. будет происходить обратная конденсация до тех пор, пока часть газа не перейдет в жидкое состояние. Аналогичная картина наблюдается при уменьшении давления при произвольной температуре в пределах Тc < t1 < TМ. При снижении давления в газовой фазе появляется жидкость, причем содержание ее сначала увеличивается (заштрихованная область), а затем уменьшается. Таким образом, в многокомпонентных углеводородных системах при изменении температуры в интервале давлений от рс до рм и при изменении давления в интервале температур от Тс до Тм происходит обратная конденсация или обратное испарение. Такие явления впервые исследовал Куенен и назвал их ретроградными. При разработке газоконденсатных месторождений ретроградные явления наблюдаются при снижении давления (область правее СВ на рис. 1.5). В процессе разработки залежи температура в ней меняется по сравнению с изменением давления несущественно. При исследовании фазового состояния углеводородных систем газоконденсатных месторождений обычно проводят соответствующие эксперименты в бомбе высокого давления. Исходные данные берут по результатам анализа продукции газоконденсатных скважин. Очевидно, для исследования начального состояния системы необходимо знать результаты анализа продукции скважин в начальной стадии эксплуатации залежи. Методы анализа и лабораторных исследований углеводородных систем газоконденсатных месторождений достаточно подробно освещены в литературе. В частности, результаты исследований газоконденсатных систем в бомбе высокого давления представляются в виде изотерм конденсации, выражающих зависимость количества выпавшего конденсата Vх (см3/м3 или г/м3 в нормальных условиях) от давления р при определенной температуре (рис. 1.6).
Давление в точке А изотермы соответствует давлению максимальной конденсации рмк для данной системы при данной температуре. Давление в точке В соответствует давлению начала конденсации рнк - это давление второй точки росы, а явление уменьшения жидкой фазы при повышении давления — явление обратного испарения. При исследовании газоконденсатной системы в бомбе рVТ процесс конденсации можно осуществлять посредством: снижения давления путем увеличения объема (при этом состав газоконденсатной системы в процессе исследования остается неизменным); снижения давления при неизменном объеме путем выпуска из бомбы газовой фазы (при этом состав газоконденсатной системы изменяется). Сравнение результатов исследований обоими методами показало, что содержание компонентов в газовой и жидкой фазах, а, следовательно, и изотермы конденсации часто практически совпадают. |