 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Факторы, влияющие на основность 12
1. Природа гетероатома в основном центре Н3С - NH2 > Н3С - OH Н3С - OH > Н3С – SH Сила оснований зависит от электроотрицательности гетероатома в основном центре. Чем больше ЭО атома, тем слабее основные свойства, поэтому спирты и простые эфиры являются более слабыми основаниями по сравнению с аминами. 2. Строение радикала, связанного с основным центром.
Алифатические амины проявляют более сильные основные свойства, чем ароматические. Объясняется это тем, что алкильные радикалы являются электронодонорами (электронная плотность на атоме азота повышается, что облегчает присоединение протона), а бензольное кольцо электроноакцептором (электронная плотность на атоме азота понижается, что затрудняет присоединение протона). Электронодонорые заместители усиливают основные свойства, а электроноакцепторные – уменьшают, например:
РКВН+ 5,1 4,6 1,0
уменьшение основности
3. Влияние растворителя В водной среде важную роль играет уменьшение пространственных препятствий для гидратации, поэтому вторичные амины лучше гидратируются, чем третичные, которые пространственно труднодоступны.
CH3
основность уменьшается
В газовой среде основность возрастает с увеличением углеводородных радикалов, так как усиливается их стабилизирующее действие за счет +I-эффекта на катион сопряженной кислоты, поэтому третичные амины проявляют более сильные основные свойства по сравнению с другими аминами.
CH3
Вопросы для самоконтроля 1. Теория Бренстеда - Лоури. Сопряженные кислоты и основания. 2. Кислотные свойства органических соединений с водородосодержащими функциональными группами (спирты, фенолы, тиолы, карбоновые кислоты, амины). 3. Основные свойства органических соединений. 4. Факторы, влияющие на реакционную способность кислот и оснований. Упражнения 1. Объясните, какое из соединений проявляет более сильные кислотные свойства и почему? а) CH3 -SH, б) CH3-NH2, в) CH3-OH. 2. Какая кислота является более сильной и почему? а) СH3COOH, б) Сl-CH2COOH, в) Cl2- CH – COOH. 3. Объясните, почему анилин проявляет более слабые основные свойства, по сравнению с этиламином. 4. Напишите реакцию, которая доказывает более сильные кислотные свойства фенола по сравнению со спиртами. 5. В качестве антидота при отравлении солями мышьяка был предложен 2,3-димеркаптопропанол. Объясните, чем определяется его большая кислотность в сравнении с пропантриолом.
Тесты для самостоятельной работы студентов Вариант 1 1. В реакцию с NaOH будет вступать:
2. Наиболее сильным основанием будет: а) аминобензол; б) 1-амино-2-метилбензол; в) 1-амино-2-нитробензол; г) 1-амино-2-гидроксибензол. 3. Кислотность пропантиола больше пропанола, т.к.: а) электроотрицательность у кислорода больше чем у серы; б) поляризуемость серы больше; в) больше молекулярная масса; г) лучшая растворимость 4. Согласно теории Бренстеда, кислотными свойствами обладают молекулы или ионы, способные: а) отдавать протон; б) отдавать электрон; в) принимать протон; г) принимать электрон. 5. Более основной характер диметиламина по сравнению с анилином доказывает реакция с: а) HNO2; б) CH3Cl; в) HCl; г) H2О
Вариант 2 1. Согласно теории Бренстеда, основными свойствами обладают молекулы или ионы, способные: а) отдавать протон; б) отдавать электрон; в) принимать протон; г) принимать электрон. 2. Более сильной кислотой является: а) пропанол-1; б) пропандиол-1,2; в) пропиламин; г) пропантиол-1 3. Более сильные кислотные свойства этантиола по сравнению с этанолом можно доказать реакцией с: а) СН3–СН2–Cl; б) HgCl2; в) NaOH; г) Na. 4. Наиболее сильными основными свойствами обладает соединение:
5. Отрицательный мезомерный эффект усиливает кислотные свойства в соединении:
Вариант 3 1. Наиболее слабым основанием является соединение: а) С2Н5–NH2; б) (С2Н5)2–NH; в) С6Н5–NH2; г) NO2–C6H4–NH2.
2. С NaOH с образованием солей будет реагировать соединение: а) пропанол-1; б) 2-метилпропанол-2; в) оксибензол; г) этиламин.
3. Этантиол является более сильной кислотой чем этиламин, т.к.: а) атом серы легче поляризуется; б) азот более электроотрицателен; в) радикал проявляет +J; г) SH-группа проявляет –J.
4. Этанол и нарколан (2,2,2-трибромэтанол) применяются в качестве нарколитических средств. Большая кислотность нарколана объясняется: а) отсутствием сопряжения; б) ЭА характером брома; в) +J эффектом радкала; г) – J эффектом ОН-группы.
5. Наиболее сильные кислотные свойства фенола по сравнению со спиртами можно доказать реакцией: а) С6Н5–ОН + Na →; б) С6Н5–ОН + НNО3 →; в) С6Н5–ОН + FeCl3 →; г) С6Н5–ОН + NaOH →;
Вариант 4 1. Наиболее слабой кислотой является: а) уксусная кислота; б) пропандиовая кислота; в) пропионовая кислота; г) щавелевая кислота; 2. Большая основность 1-амино-2-метилбензола по сравнению с анилином объясняется: а) – J эффектом NH2-группы; б) +М эффектом NH2-группы; в) ЭД характером группы СН3; г) ЭА характером NH2-группы; 3. Большие кислотные свойства глицерина по сравнению с пропанолом проявляются в реакции с: а) HCl; б) Cu(OH)2; в) CuO; г) CH3–OH; 4. С Na2CO3 как более сильная кислота будет взаимодействовать соединение:
5. Соединение, способное образовывать соли с HgO: а) фенол; б) 1,2-диоксибензол; в) пропантиол-2; г) пропандиол-1,2;
Вариант 5 1. Основность соединений зависит от: а) молекулярной массы; б) характера заместителя; в) температуры г) давления. 2. В реакции с СН3СООН более сильные основные свойства доказывает соединение: а) С2Н5–ОН + СН3СООН →; б) С6Н5–NН2 + СН3СООН →; в) СН3–CH2–NН2 + СН3СООН →; г) СН3–COОН + Na → 3. Более сильные кислотные свойства этантиола по сравнению с этиламином можно объяснить: а) + J эффектом заместителя; б) – J эффектом SH-группы; в) – J эффектом NН2-группы; г) большей поляризуемостью атома серы. 4. Наиболее сильным основанием является соединение: а) СН3–NH2; б) СН3–СН2–NH–СН3; в) С6Н5–NH2; г) С6Н5–NH–C6H5. 5. Стабильность аниона зависит: а) числа атомов водорода в радикале; б) величина радикала; в) заряд ядра; г) делокализации электронной плотности. Ответы к тестам “Кислотность и основность”
Тюкавкина Н. А., Органическая химия, 2002 г. С. 100-101, 108-109. 12 |



 анилин Н3С → СН2 → NH2 этиламин
анилин Н3С → СН2 → NH2 этиламин 4-хлоранилин
4-хлоранилин  анилин
анилин 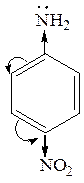 4-нитроанилин
4-нитроанилин
 H3C - NH – CH3 > H3C – NH2 > H3C - N – CH3
H3C - NH – CH3 > H3C – NH2 > H3C - N – CH3
 H3C - N – CH3 > H3C - NH – CH3 > H3C – NH2
H3C - N – CH3 > H3C - NH – CH3 > H3C – NH2 основность уменьшается
основность уменьшается


