 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Енергетика хімічних процесів
(термохімічні розрахунки) Науку про взаємні перетворення різних видів енергії називають термодинамікою. Термодинаміка встановлює закони цих перетворень, а також напрямок самочинного перебіг у різних хімічних процесів у заданих умовах. В процесі хімічних реакцій рвуться хімічні зв'язки у вихідних речовинах і виникають нові зв'язки в кінцевих продуктах. Ці зміни супроводжуються поглинанням або виділенням енергії. Розділ термодинаміки, який вивчає теплові ефекти хімічних реакцій, називають термохімією. Реакції, що супроводжуються виділенням теплоти, називають екзотермічними, а ті, котрі супроводжуються поглинанням теплоти - ендотермічними. При будь-якому процесі виконується закон збереження енергії як прояв більш загального закону природи - закону збереження матерії. Теплота
Внутрішня енергія системи Теплота і робота не є функціями стану. Вони служать формами передачі енергії і залежать від процесів, а не від стану системи. При хімічних реакціях
Суму
Величину Нназивають ентальпією. Таким чином, теплота при
Ентальпія, як і внутрішня енергія, є функцією стану і її зміна (
При екзотермічних реакціях ентальпія системи зменшується і Термохімічні розрахунки базуються на законі Гесса (1640): тепловий ефект реакції залежить тільки від природи та фізичного стану вихідних речовин та кінцевих продуктів, і не залежить від шляху процесу. Часто в термохімічних розрахунках застосовують наслідок із закону Гесса: тепловий ефект реакції
Приклад 1. При взаємодії кристалів хлориду фосфору (V) з парою води утворяться рідкий Рішення. У термохімічних рівняннях, якщо це спеціально не обговорено, вказуються значення теплових ефектів при постійному тиску Значення В результаті реакції виділяється теплота. Отже,
Стандартні теплоти (ентальпії) утворення
Приклад 2. Реакція горіння етану виражається термохімічним рівнянням
Обчисліть теплоту утворення етану, якщо відомі теплоти утворення Рішення. Теплотою утворення (ентальпією) даної сполуки називають тепловий ефект реакції утворення 1 моль цієї сполуки з простих речовин, узятих у їхньому стійкому стані. Звичайно теплоти утворення відносять до стандартного стану, тобто температури 25 0С (298 К) і тиску, рівного атмосфері
виходячи з наступних даних: а) б) в) На підставі закону Гесса з термохімічними рівняннями можна оперувати так само, як і з алгебраїчними. Для одержання шуканого результату слід рівняння (б) помножити на 2, рівняння (в) - на 3, а потім суму цих рівнянь відняти від рівняння (а) :
Оскільки теплота утворення дорівнює теплоті розкладання з протилежним знаком, то
Враховуючи те, що теплоти утворення простих речовин умовно прийняті рівними нулеві, одержимо:
Приклад 3. Реакція горіння етилового спирту виражається термохімічним рівнянням
Обчислити тепловий ефект реакції, якщо відомо, що молярна теплота пароутворення Рішення. Для визначення ентальпіїреакції
+42,36 = -235,31 -
Обчислимо
Контрольні питання
81. Знайдіть, яка кількість теплоти виділиться при відновленні 82. При взаємодії газоподібних сірководню і діоксиду вуглецю утворяться пара води і сірковуглець 83. Напишіть термохімічне рівняння реакції між 84. Кристалічний хлорид амонію утворюється при взаємодії газоподібних аміаку і хлориду водню. Напишіть термохімічне рівняння цієї реакції, обчисливши її тепловий ефект. Скільки теплоти виділиться, якщо в реакції було витрачено 637 г аміаку. 85. Тепловий ефект реакції згоряння рідкого бензолу з утворенням водяної пари і діоксиду вуглецю дорівнює -3135,58 кДж. Складіть термохімічне рівняння цієї реакції й обчисліть теплоту утворення 86. Обчисліть, скільки теплоти виділиться при згорянні взятих при нормальних умовах 8 кг етилового спирту, якщо продуктами згоряння є діоксид вуглецю і пара води? 87. При відновленні 12,7 г оксиду міді (ІІ) вугіллям (з утворенням 88. При повному згоранні етилену (з утворенням рідкої води) виділилося 6226 кДж. Знайти об‘єм кисню, який вступає у реакцію (умови нормальні). 89. Водяний газ являє собою суміш рівних об‘ємів водню і окису вуглецю (ІІ). Знайти кількість теплоти, що виділяється при спалюванні 112 л водяного газу, взятого при нормальних умовах. 90. Спалені з утворенням 91. Визначити 92. Визначити
93. Порівняти а) б) в) 94. При сполученні 2,1 г заліза із сіркою виділилося 3,77 кДж. Розрахувати теплоту утворення сульфіду заліза. 95. Знайти кількість теплоти, що виділяється при вибухові 8,4 л гримучого газу, взятого при нормальних умовах. 96. Розрахувати
97. Виходячи з
обчислити 98. Розрахувати а) б) 99. Обчислити значення а) б) 100. Обчисліть тепловий ефект реакції відновлення оксиду заліза (II) воднем, виходячи з таких термохімічних рівнянь:
82. Пару етилового спирту 86. Тепловий ефект якої реакції дорівнює теплоті утворення
88. Тепловий ефект якої реакції дорівнює теплоті утворення метану? Обчисліть теплоту утворення метану, виходячи з таких термохімічних рівнянь;
89. Тепловий ефект якої реакції дорівнює теплоті утворення гідроксиду кальцію? Обчисліть теплоту утворення гідроксиду кальцію, виходячи з таких термохімічних рівнянь: 2Са(к) + О2(г) = 2СаО(к); 2Н2(г) + О2(г) = 2Н2О(р); СаО(к) + Н2О(р) = Са(ОН)2(к); 93. Реакція горіння метилового спирту виражається термохімічним рівнянням СН3ОН(р) + Обчисліть тепловий ефект цієї реакції, якщо відомо, що мольна теплота пароутворення СН3ОН(р) дорівнює +37,4 кДж/моль. 95. Реакція горіння бензолу виражається термохімічним рівнянням 2С6Н6(р) + 15О2(г) = 12СО2(г) + 6Н2О(г); Обчисліть тепловий ефект цієї реакції, якщо відомо, що мольна теплота пароутворення бензолу дорівнює +33,9 кДж/моль. 97. Реакція горіння аміаку виражається термохімічним рівнянням 4NH3(г) + 3О2(г) = 2N2(г) + 6Н2О(р); Обчисліть теплоту утворення NH3(г). 98. При взаємодії 6,3 гзаліза із сіркою виділилося 11,31 кДж теплоти. Обчисліть теплоту утворення сульфіду заліза Fe. 99. При згорянні в нормальних умовах 1 л ацетилену виділяється 56,053 кДж теплоти. Напишіть термохімічне рівняння реакції, в результаті якої утворяться водяна пара і діоксид вуглецю. Обчисліть теплоту утворення С2Н2(г). 100. При одержанні еквівалентної маси гідроксиду кальцію із СаО(к) і Н2О(р) виділяється 32,53 кДж теплоти. Напишіть термохімічне рівняння цієї реакції й обчисліть теплоту утворення оксиду кальцію. 92. При згорянні газоподібного аміаку утворяться пари води й оксид азоту. Скільки теплоти виділиться у цій реакції, якщо було отримано 500 л NO у перерахунку на нормальні умови? 94. При згорянні 149,5 г рідкого етилового спирту виділилося 4013,23 кДж теплоти. Напишіть термохімічне рівняння реакції, у результаті якої утворяться водяна пара і діоксид вуглецю. Обчисліть теплоту утворення С2Н5ОН(р). 96. Обчисліть тепловий ефект і напишіть термохімічне рівняння реакції горіння одного моля етану С2Н6(г) з утворенням водяної пари і діоксиду вуглецю. Скільки теплоти виділиться при згорянні 1 м3 етану в перерахунку на нормальні умови?
Хімічна спорідненість Самочинно можуть протікати реакції, що супроводжуються не тільки виділенням, а й поглинанням теплоти. Реакція, що йде при даній температурі з виділенням теплоти, при іншій температурі проходить з поглинанням теплоти. Тут виявляється діалектичний закон єдності і боротьби протилежностей. З одного боку, система прагне до упорядкування (агрегації), до зменшення Н;з іншого боку, система прагне до безладдя (дезагрегації). Перша тенденція проявляється зі зниженням, а друга - з підвищенням температури. Тенденцію до хаосу характеризує величина, що називається ентропією. Ентропія S, як і внутрішня енергія U, ентальпія Н, об‘єм Vта ін., є властивістю речовини, пропорційною її кількості. S, U, Н, Vволодіють адитивними властивостями, тобто при зіткненні системи додаються. Ентропія відбиває рух часток речовини і є мірою невпорядкованості системи. Вона зростає зі збільшенням руху часток: при нагріванні, випарі, плавленні, розширенні газу, при ослабленні або розриві зв'язків між атомами і т.п. Процеси, зв'язані з упорядкованістю системи: конденсація, кристалізація, стискання, зміцнення зв'язків, полімеризація і т.п., - ведуть до зменшення ентропії. Ентропія є функцією стану, тобто її зміна
Оскільки ентропія росте з підвищенням температури, то можна вважати, що міра безладу
Величина Gназивається ізобарно-ізотермічним потенціалом або енергією Гіббса. Отже, мірою хімічної спорідненості є надлишок енергії Гіббса (
Процеси, які протікають мимовільно, ідуть вбік зменшення потенціалу і, зокрема, вбік зменшення Зі співвідношення
Таблиця 6. Стандартна енергія Гіббса утворення
Приклад 1. У якому стані ентропія 1 моль речовини більше: у кристалічному чи у пароподібному при тій же температурі? Рішення. Ентропія є міра невпорядкованості стану речовини. У кристалі частинки (атоми, іони) розташовані упорядковано і можуть перебувати лише в певних точках простору, а для газу таких обмежень немає. Об'єм 1 моль газу набагато більше, ніж об'єм 1 моль кристалічної речовини; можливість хаотичного руху молекул газу більше. А через те, що ентропію можна розглядати як кількісну міру хаотичності атомно-молекулярної структури речовини, то ентропія 1 моль пари речовини більше ентропії 1 моль його кристалів при однаковій температурі. Приклад 2. Пряма або зворотна реакція буде протікати при стандартних умовах у системі СН4(г) + СО2(г) Рішення. Для відповіді на питання треба обчислити
Те, що
Та б л и ц я 7. Стандартні абсолютні ентропії
Приклад 3. На підставі стандартних теплот утворення (табл. 5) і абсолютних стандартних ентропії речовин (табл. 7) обчисліть CO(г) + H2O(р) = CO2(г) + H2(г)
Рішення.
Приклад 4. Реакція відновлення Fe2O3 воднем протікає за рівнянням Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3H2O(р); Чи можлива ця реакція при стандартних умовах, якщо зміна ентропії Рішення. Обчислюємо
Оскільки
Отже, при температурі Приклад 5. Обчисліть Fe2O3(к) + 3C = 2Fe + 3CO Чи можлива реакція відновлення Fe2О3 вуглецем при температурах 500 і 1000 К? Рішення.
Енергію Гиббса при відповідних температурах знаходимо зі співвідношення
Оскільки
Контрольні питання
101. Обчисліть а) 2Na(к) + Cl2(р) =2NaCl(к) + F2(г) б) Pb2(к) + 2Zn(к) = Pb(к) + 2Zn(к) Чи можна одержати фтор за реакцією (а) і відновити РЬО2 цинком за реакцією (б)? 102. При якій температурі настане рівновага системи 4HCl(г) + О2(г) Хлор або кисень у цій системі є більше сильним окислювачем і при яких температурах? 103. Відновлення Fe2O3 оксидом вуглецю йде за рівнянням: Fe3O4(к) + СО(г) = 3Fe(к) + СО2(г) Обчисліть 104. Реакція горіння ацетилену йде за рівнянням: С2Н2(г) + 5/2О2(г) = 2СО2(г) + Н2О(р) Обчисліть 105. Зменшується або збільшується ентропія при переходах: а) води в пару; б) графіту в алмаз? Чому? Обчисліть 106. Чим можна пояснити те, що при стандартних умовах неможлива екзотермічна реакція Н2(г) + СО2(г) = СО(г) + Н2О(р); Знаючи тепловий ефект реакції й абсолютні стандартні ентропії відповідних речовин, визначте 107. Пряма або зворотна реакція буде протікати при стандартних умовах у системі 2NO(г) + О2(г) Відповідь мотивуйте, обчисливши 108. Виходячи зі значень стандартних теплот утворення й абсолютних стандартних ентропії відповідних речовин, обчисліть NH3(г) + HCl(г) = NH4Cl(к) Чи може ця реакція при стандартних умовах іти мимовільно? 109. При якій температурі наступить рівновага системи СО + 2Н2(г) 110. При якій температурі наступить рівновага системи СН4(г) + З2(г) = 2СО(г) + 2Н2(г); 111. На підставі стандартних теплот утворення й абсолютних стандартних ентропії відповідних речовин обчислите 4NH3(г) + 5О2(г) = 4NO(г) + 6Н2О(г) Чи можлива ця реакція при стандартних умовах? 112. На підставі стандартних теплот утворення й абсолютних стандартних 3О2(г) + 4Н2(г) = СН4(г) + 2Н2О(р) Чи можлива ця реакція при стандартних умовах? 113. Обчисліть Fe2O3(к) + 3H2(г) = 2Fe(к) + 3H2O(г) Чи можлива реакція відновлення Fe2O3воднем при температурах 500 і 2000 К? 114. Які з карбонатів: ВеСО3 або ВаСО3 - можна одержати за реакцією взаємодії відповідних оксидів із СО2? Яка реакція йде найбільш енергійно? Висновок зробіть, обчисливши 115. На підставі стандартних теплот утворення й абсолютних стандартних ентропій відповідних речовин обчисліть СО(г) + 3Н2(г) = СН4(г) + Н2О(г) Чи можлива ця реакція при стандартних умовах? 116. Обчисліть ТiO2(к) + 2С(к)= Ті(к) + 2СО(г) Чи можлива реакція відновлення TiО2 вуглецем при температурах 1000 і 3000 К? 117. На підставі стандартних теплот утворення й абсолютних стандартних ентропій відповідних речовин обчисліть С2Н4(г) + 3О2(г) = 2СО2(г) + 2Н2О(р) Чи можлива ця реакція при стандартних умовах? 118. Визначите, при якій температурі почнеться реакція відновлення Fe3O4, що протікає за рівнянням: Fe3O4(к) + CО(г) = 3FeО(к) + CO2(г); 119. Обчислите, при якій температурі почнеться дисоціація пентахлориду РС15(г) = РС13(г) + Cl2(г); 120. Обчисліть зміну ентропії для реакцій, що протікають за рівняннями: 2СН4 (г) = С2Н2(г) + СН2(г) N2(г) + 3H2(г) = 2NH3(г) С (графіт) + О2(г) = СО2(г) Чому в цих реакціях 113. Розрахувати значення а) б) в) 114. Встановити, протікання яких з нижченаведених реакцій можливе в стандартних умовах при 25 0С: а) б) в) 115. Розрахувати значення а) б) в) 116. Які з перелічених оксидів можуть бути відновлені алюмінієм при 298 К: 117. Які з перелічених оксидів можуть бути відновлені воднем до вільного металу при 298 К:
|



 , поглинена системою, витрачається на зміну її внутрішньої енергії
, поглинена системою, витрачається на зміну її внутрішньої енергії  і на здійснення роботи
і на здійснення роботи  :
: .
. - це загальний її запас, що включає кінетичну енергію руху молекул, їхню потенціальну енергію, енергію руху електронів і т.д. Абсолютне значення внутрішньої енергії
- це загальний її запас, що включає кінетичну енергію руху молекул, їхню потенціальну енергію, енергію руху електронів і т.д. Абсолютне значення внутрішньої енергії 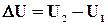 ,де
,де  до кінцевого
до кінцевого  . Якщо
. Якщо  то
то  . Якщо
. Якщо  ,то
,то  .
. , де
, де 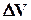 - зміна об‘єму системи
- зміна об‘єму системи  ,
,  - тиск. Оскільки більшість хімічних реакцій проходить при постійному тиску, то для ізобарно-ізотермічного процесу (
- тиск. Оскільки більшість хімічних реакцій проходить при постійному тиску, то для ізобарно-ізотермічного процесу (  ,
,  ) теплота
) теплота ,
, ;
; .
. позначимо через
позначимо через  , тоді
, тоді .
.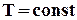 набуває властивості функції стану і не залежить від шляху, по якому протікає процес. Теплота реакції в ізобарно-ізотермічному процесі
набуває властивості функції стану і не залежить від шляху, по якому протікає процес. Теплота реакції в ізобарно-ізотермічному процесі  дорівнює зміні ентальпії системи
дорівнює зміні ентальпії системи  (якщо єдиним видом роботи є робота розширення) :
(якщо єдиним видом роботи є робота розширення) : .
. ;
;  .
.
 а при ендотермічних ентальпія системи збільшується і
а при ендотермічних ентальпія системи збільшується і 
 .
. дорівнює сумі теплот утворення
дорівнює сумі теплот утворення  продуктів реакції за винятком суми теплот утворення реагентів із врахуванням коефіцієнтів перед формулами цих речовин у рівнянні реакції
продуктів реакції за винятком суми теплот утворення реагентів із врахуванням коефіцієнтів перед формулами цих речовин у рівнянні реакції . (1)
. (1) і
і  . Реакція супроводжується виділенням 111,4 кДж теплоти. Напишіть термохімічне рівняння цієї реакції.
. Реакція супроводжується виділенням 111,4 кДж теплоти. Напишіть термохімічне рівняння цієї реакції. ;
;  = -111,4 кДж.
= -111,4 кДж. деяких речовин
деяких речовин




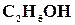


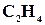









 ;
;  і
і  (взяті з таблиці).
(взяті з таблиці). . Позначають стандартну ентальпію утворення через
. Позначають стандартну ентальпію утворення через 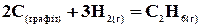 ;
;  ;
;  ;
;  ;
; 
 = -84,67 кДж. До такого ж результату прийдемо, якщо для рішення задачі застосувати наслідок із закону Гесса:
= -84,67 кДж. До такого ж результату прийдемо, якщо для рішення задачі застосувати наслідок із закону Гесса:
 ;
; ;
; кДж.
кДж. ;
;  = ?
= ? дорівнює +42,36 кДж/моль і відомі теплоти утворення:
дорівнює +42,36 кДж/моль і відомі теплоти утворення:  ;
;  ;
;  = 42,36 кДж.
= 42,36 кДж. ;
; металічним алюмінієм, якщо було отримано 2 кг заліза.
металічним алюмінієм, якщо було отримано 2 кг заліза. . Напишіть термохімічне рівняння цієї реакції, обчисливши її тепловий ефект. Знайдіть кількість теплоти, що виділиться або поглинеться, якщо прореагувало 5 кг сірководню.
. Напишіть термохімічне рівняння цієї реакції, обчисливши її тепловий ефект. Знайдіть кількість теплоти, що виділиться або поглинеться, якщо прореагувало 5 кг сірководню. і воднем, у результаті якої утворяться
і воднем, у результаті якої утворяться  і
і  . Скільки теплоти виділиться при цій реакції, якщо було отримано 824 л метану в перерахунку на нормальні умови?
. Скільки теплоти виділиться при цій реакції, якщо було отримано 824 л метану в перерахунку на нормальні умови? . Скільки виділиться теплоти при згоранні 10 кг бензолу?
. Скільки виділиться теплоти при згоранні 10 кг бензолу? .
. , якщо
, якщо  ;
; ;
; .
. ;
; ;
; .
. при 298 К, користуючись наступними даними:
при 298 К, користуючись наступними даними: ;
; ;
; .
. ;
;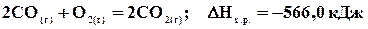 .
. реакцій:
реакцій: ;
; .
. ;
; .
. ;
;  ;
;  ;
;  і пари води. Напишіть термохімічне рівняння цієї peaкції, обчисливши її тепловий ефект.
і пари води. Напишіть термохімічне рівняння цієї peaкції, обчисливши її тепловий ефект. ? Обчисліть теплоту утворення
? Обчисліть теплоту утворення  ;
; 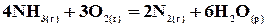 ;
;  ;
;  ;
;  ;
;  О2(г) = СО2(г) + 2Н2О(р);
О2(г) = СО2(г) + 2Н2О(р);  залежить тільки від початкового
залежить тільки від початкового  і кінцевого
і кінцевого  стану і не залежить від шляху процесу:
стану і не залежить від шляху процесу: (2)
(2) . Якщо
. Якщо  , то
, то  . Якщо
. Якщо  , то
, то  .
.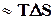 . Ентропія виражається в Дж/(
. Ентропія виражається в Дж/( 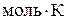 ). Таким чином, рушійна сила процесу складається із двох сил: прагнення до впорядкування (Н)і прагнення до безладу (TS). При р = const і Т = const загальну рушійну силу процесу, що позначають
). Таким чином, рушійна сила процесу складається із двох сил: прагнення до впорядкування (Н)і прагнення до безладу (TS). При р = const і Т = const загальну рушійну силу процесу, що позначають  , можна знайти зі співвідношення
, можна знайти зі співвідношення ;
;  .
. (3)
(3) .
. видно, що мимовільно можуть протікати і ті процеси, для яких
видно, що мимовільно можуть протікати і ті процеси, для яких  > 0 (ендотермічні). Це можливо, коли
> 0 (ендотермічні). Це можливо, коли  > 0, але
> 0, але  ,і тоді
,і тоді  деяких речовин
деяких речовин 2СО(г) + 2Н2(г).
2СО(г) + 2Н2(г).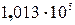 Па (760 мм рт. ст. = 1 атм).
Па (760 мм рт. ст. = 1 атм).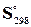 деяких речовин
деяких речовин ;
;  ;
;  .
. кДж.
кДж. (213,65 + 130,59) - (197,91 + 69,94) = +76,39 = 0,07639 кДж/(
(213,65 + 130,59) - (197,91 + 69,94) = +76,39 = 0,07639 кДж/(  = +2,85 -
= +2,85 -  = -19,91 кДж.
= -19,91 кДж. = +96,61 кДж.
= +96,61 кДж.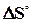 = 0,1387 кДж/(
= 0,1387 кДж/(  = +55,28 кДж.
= +55,28 кДж. , то реакція при стандартних умовах неможлива; навпаки, при цих умовах іде зворотна реакція окислювання заліза (корозія). Знайдемо температуру, при якій
, то реакція при стандартних умовах неможлива; навпаки, при цих умовах іде зворотна реакція окислювання заліза (корозія). Знайдемо температуру, при якій  :
: ;
;  К.
К. 696,5 К почнеться реакція відновлення. Іноді цю температуру називають температурою початку реакції.
696,5 К почнеться реакція відновлення. Іноді цю температуру називають температурою початку реакції.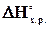 ,
,  і
і  реакції, що протікає за рівнянням
реакції, що протікає за рівнянням кДж;
кДж;  Дж/К.
Дж/К. :
:
 кДж;
кДж;
 кДж.
кДж. , a
, a  , то відновлення Fe2O3 вуглецем можливе при 1000 К и неможливе при 500 К.
, то відновлення Fe2O3 вуглецем можливе при 1000 К и неможливе при 500 К. = -114,42 кДж?
= -114,42 кДж? в цьому процесі?
в цьому процесі? ; < 0;
; < 0;  ?
? ;
; ;
; .
. ;
; ;
; ;
; ;
; .
. ,
,  ,
,  ,
,  ?
? ,
,  ,
,  ,
,