 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Малоновый эфир и синтезы на его основе
Непредельные и дикарбоновые кислоты I. непредельные монокарбоновые кислоты
Номенклатура, изомерия
Тривиальные названия:
Заместительная (систематическая) номенклатура:
Геометрическая изомерия:
кротоновая кислота (транс-изомер) изокротоновая (цис-изомер)
олеиновая (цис-изомер) элаидиновой (транс-изомер). Строение
Химические свойства 1). Кислотность
2). Реакции присоединения
3). Реакции радикального замещения
В результате отрыва атома водорода от метиленовой группы, расположенной между двойными связями, образуется свободный радикал, стабилизированный p-р-p-сопряжением. Например:
CH3-(CH2)4-CH=CH-CH2-CH=CH-(CH2)7-COOH + X× ®
® CH3-(CH2)4-CH=CH-ĊH-CH=CH-(CH2)7-COOH + HX
Способы получения
(Х= -ОН, -Cl, -Br, -CN) II. дикарбоновые кислоты и их производные
HООC-R-CООH где R — двухвалентный углеводородный радикал
Тривиальные названия:
Малеиновая и фумаровая кислоты являются геометрическими изомерами и заметно различаются по своим физическим и химическим свойствам.
Заместительная номенклатура: HООC–СН2–CООNa — гидропропандиоат натрия (или пропандиоат натрия-водорода), HООC–СН2–СН2–CОCl — 4-оксо-4-хлорбутановая кислота. Особенности химического поведения 1). Кислотность
2). Отношение к нагреванию
а) щавелевая и малоновая кислоты — декарбоксилирование:
НООС-CООН муравьиная кислота НООС-СН2-CООН уксусная кислота
Механизм, например, для малоновой кислоты:
Щавелевая кислота при нагревании в присутствии концентрированной серной распадается дальше: НООС-CООН
Малоновая кислота при нагревании с фосфорным ангидридом образует диоксид триуглерода С3О2 («недокись углерода»): НООС-СН2-CООН
б) янтарная и глутаровая кислоты образуют внутренние циклические ангидриды:
Механизм:
Аналогично для малеиновой кислоты:
в) для адипиновой и высших кислот:
3). Свойства циклических ангидридов и имидов
4). Конденсация малоновой кислоты с альдегидами
Конденсация Кнёвенагеля:
Малоновый эфир и синтезы на его основе Малоновый эфир и малоновая кислота относятся к b-дикарбонильным соединениям.
Синтез монокарбоновых кислот H5C2OOC-CH2-COOC2H5
Синтез дикарбоновых кислот
а)
Br–CHR–CHR¢–Br.
Схема синтеза:
2 H5C2OOC-CH2-COOC2H5
б)
Br–CHR–COOC2H5.
Схема синтеза: H5C2OOC-CH2-COOC2H5
в)
Тогда легко видеть, что прежде чем «сшить» между собой молекулярным йодом два моля натриймалонового эфира, его необходимо проалкилировать, введя радикал R. Следовательно, схема синтеза a,a¢–диалкилянтарной кислоты приобретает вид:
2 H5C2OOC-CH2-COOC2H5 ® 2 H5C2OOC-CHR-COOC2H5
Способы получения
1) Окисление спиртов, альдегидов, кетонов, например: НOCН2-(CH2)n-СН2OH
2) гидролиз ацильных производных, гидратация нитрилов и другие реакции по ацильной группе (для получения производных кислот), например: Н5С2OOC-(CH2)n-СOOC2H5 NºC-(CH2)n-CºN
3) металлорганический синтез — карбоксилирование реактивов Гриньяра или литийорганических соединений, например: ClMg-(CH2)n-MgCl ® НOOC-(CH2)n-СOOH
4) Электролиз щелочных растворов моноэфиров дикарбоновых кислот: 2 ROOC-(CH2)n-СOO- ® ROOC-(CH2)2n-COOR
|





















 НСООН + СО2
НСООН + СО2 СН3СООН + СО2
СН3СООН + СО2
 СО2 + СО + Н2О
СО2 + СО + Н2О О=С=С=С=О + Н2О
О=С=С=С=О + Н2О





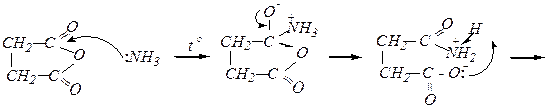








 [H5C2OOC-CH-COOC2H5]¯ Na+ ®
[H5C2OOC-CH-COOC2H5]¯ Na+ ® H5C2OOC-CHR-COOC2H5
H5C2OOC-CHR-COOC2H5  H5C2OOC-CRR’-COOC2H5 ®
H5C2OOC-CRR’-COOC2H5 ® HOOC-CRR’-COOH
HOOC-CRR’-COOH  RR’CH-COOH + CO2
RR’CH-COOH + CO2

 2[H5C2OOC-CH-COOC2H5]¯ Na+
2[H5C2OOC-CH-COOC2H5]¯ Na+
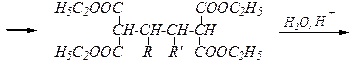


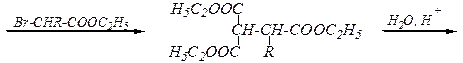






 НOOC-(CH2)n-СOOH
НOOC-(CH2)n-СOOH
 НOOC-(CH2)n-СOOH
НOOC-(CH2)n-СOOH ClMg-OOC-(CH2)n-СOO-MgCl
ClMg-OOC-(CH2)n-СOO-MgCl  2 ROOC-(CH2)n-СOO×
2 ROOC-(CH2)n-СOO× 
 HOOC-(CH2)2n-COOH
HOOC-(CH2)2n-COOH