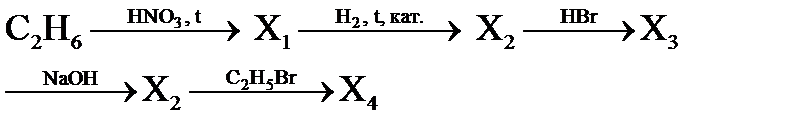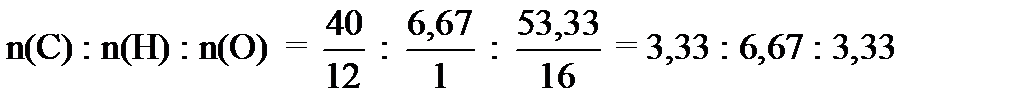ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| для студентов заочной формы обучения группы ОПсз-122
КОНТРОЛЬНЫЕ ЗАДАНИЯ по Органической химии Каждый студент выполняет вариант контрольных заданий, обозначенный номером в списке журнала.
1. Задание. Напишите продукты реакции, которые образуются в результате следующих превращений и назовите их 1) Нагревание 3-хлорпентановой кислоты 2) Прокалить смесь ацетата т формиата кальция 3) Гидролиз 2,2-дихлорпропановой кислоты 4) Окисление 2-метил – 3-оксибутановой кислоты 5) Гидролиз 2,4-дихлорпентановой кислоты 6) Ацилированиеаминохлорбензола 7) Нитрование толуола 8) Взаимодействие 3-изопропилпиррола с азотистой кислотой 9) Взаимодействие пентанона-3 сциановодородом 10) Полное гидрировании пропеналя (акролеина) 11) Гидролизфенилацетата в избытке щелочи 12) Щелочное сплавление сульфобензола 13) Гидролизацияалкоксида магния 14) Окисление L-фруктозы 15) Перегруппировка Кляйзенааллифенилового эфира 16) Межмолекулярная дегидратация пропанола-2 17) Гидрогенизация триолеата глицерина 18) Полимеризация хлористого винила 19) Действие цинковой пыли на2,3-дибром-2-метилбутан и на 2,3-дихлор-4,4-диметилпентан. 20) Взаимодействия изопрена с бромом, бромоводородом. 21) Ацетилена с хлороводородом. Какими свойствами обладает полученное вещество? 22) Присоединения воды, хлороводорода к бутену-1. 23) Полимеризация углеводорода С4Н8 с разветвленным углеродным скелетом 24) 2-метилпропанол-1 из ацетилена 25) Восстановлении водородом 3-метилпентанона-2 26) Реакция получения дивинила из метана 27) Взаимодействие металлического натрия на смесь, состоящую из 1-йодпропана и 2-метил-3-йодбутана (реакция Вюрца)
2. Задание. Напишите структурные формулы следующих соединений 1) 3-нитропиррол 2) α-аминомасляная кислота 3) метилпропилизопропилэтилметан 4) 3-метилпиразол 5) глицин 6) Фурфурол 7) 3,5-диметилтиофен 8) Диметилфумарат 9) Гидрохлорид этилового эфира гликокола 10) 3-метилбифенила 11) n-толуолдиазонийхлорид 12) гидразобензол 13) акрилонитрил 14) тетраметилендихлорид 15) метилвинилкетон 16) ангидрид янтарной кислоты 17) дибутиламин 18) иодистыйаллил 19) эпоксиэтилен 20) изобутилацетилен 21) глицеринтринитрат 22) этилэтаноат 23) ацетонитрил 24) Этилдиизопропилвтор-бутилметан 25) бромистыйбутирил; 26) 1,2-циклогександиол; 27) адипиновойкислоты
3. Задание. Осуществить цепочку превращения 1) CH3NH2 →CH3NH3HSO4 →CH3NH2 →CH3NO2 2) Гексан → циклогексан → диметилциклогексан → диоксид углерода. 3) C6H6 → С6Н5NO2→C6H5NH2→ C6H5NH3Cl 4)
5) Этилен → ацетилен → хлорвинил → полихлорвинил 6) CH3NH2 →CH3NO2 →CO2 →CO →CH3OH 7) Метан → ацетилен → виниловый спирт → ацетальдегид 8) СН4→С2Н2 →С6Н6 →С6Н5NO2→C6H5NH2 9)
10) Пропан → гексан → циклогексан → бензол → гексахлорциклогексан 11) CH3OH→ CH3Br→ CH3OH →HCOH →HCOONH4 12) Ацетилен → бензол → стирол → полистирол 13) метан→Х1→уксусный альдегид→X2→Х3→ аминоуксусная кислота 14) C2H5OH→CH3COOH →ClCH2COOH → NH2CH2COOH 15) C2H2→CH3COH → CH3COOH → ClCH2COOH →NH2CH2COOH 16) C2H4Cl2→C2H2 →C6H6 → С6Н5NO2→C6H5NH2 17) CH4 →CH3Cl →CH3NH2 →CH3NH3Cl 18) C3H7Cl →C6H14 →C6H6 → С6Н5NO2 →2,4,6-триброманилин 19)
20) C6H6→X→Y→C6H5CH2OH (бензиловый спирт) 21) пропанол-1→X→Y→фенол 22)
23) СН4 →X → СН3ОН → СН3 – О – СН3 24) C2H2 → CH3COH → X → CH3COONa 25)
26) CH4 → C2H2 → X → CH3CH2OH 27)
4. Задание Расчетная задача 1. Определите формулу углеводорода, массовая доля углерода в котором 80 %. 2. Плотность углеводорода по кислороду равна 1,75, массовая доля водорода в нем равна 14,3 %. Определите молекулярную формулу углеводорода. 3. Массовая доля кислорода в предельном одноатомном спирте равна 18,18 %. Установите молекулярную формулу спирта. 4. При взаимодействии ацетиленового углеводорода с избытком раствора хлора образуется соединение, массовая доля хлора в котором 63,39%. Установите молекулярную формулу исходного алкина. 5. При каталитическом гидрировании 23,2 г альдегида было получено 24 г соответствующего спирта. Определите исходный альдегид. 6. При дегидратации 18,5 г предельного одноатомного спирта образовался алкен, объем которого (н.у.) равен 3,36 л. Выход в реакции дегидратации составил 60 %. Определите молекулярную формулу исходного спирта. 7. При дегидратации предельного одноатомного спирта объемом 66 мл (р = 0,85 г/мл) образовалось 46,2 г неразветвленного алкена симметричного строения. Назовите исходный спирт. 8. Альдегид, образовавшийся при окислении 15 г предельного одноатомного спирта с выходом 80 %, окислили аммиачным раствором оксида серебра. Реакция прошла с выходом 80 %, и образовалось 34,56 г серебра. Назовите исходный спирт. 9. При сгорании алкана образуется 94,08 л (н.у.) углекислого газа и 86,4 г воды. Определите молекулярную формулу алкана. 10. При сгорании арена массой 32,2 г выделилось 107,8 г оксида углерода (IV). Установите формулу арена. 11. При сгорании алкена образуется 40,32 л углекислого газа (н.у.) и 32,4 г воды. Такое же количество этого углеводорода обесцвечивает 3200 г бромной воды с массовой долей брома 3 %. Определите молекулярную формулу углеводорода. 12. При реакции циклоалкана с хлороводородом образуется вторичное галогенпроизводное, массовая доля хлора в котором 38,38 %. Определите структурную формулу циклоалкана и назовите его по систематической номенклатуре. 13. При сгорании смеси двух изомерных алканов образовалось 58,24л (н.у.) углекислого газа и 58,5 г воды. Сколько атомов углерода в молекулах изомеров. 14. При сгорании 18,4 г органического соединения образовалось 17,92 л (н.у.) углекислого газа и 21,6 г воды. Определите простейшую формулу соединения. 15. К 11,1 г одноосновной органической кислоты добавили сначала 14 г 20 %-ного раствора гидроксида натрия, а затем избыток раствора карбоната калия. При этом выделилось 896 мл (н.у.) газа. Назовите кислоту. 16. Для получения 58,68 г монобромпроизводногоциклоалкана неизвестного строения использован раствор, содержащий 96 г брома, причем реакция протекала с выходом 60 %. Установите число изомерных циклоалканов, удовлетворяющих данному условию. 17. При монобромировании ароматического углеводорода в присутствии железного катализатора выделился бромоводород, на нейтрализацию которого потребовалось 80 г 10 %-ного раствора гидроксида натрия. При сгорании того же количества этого арена выделилось 35,84 л (н.у.) оксида углерода (IV). Установите число изомеров, которые имеет этот арен. 18. При бромировании гомолога бензола в присутствии железа образовалось 95,52 г монобромпроизводного и выделился бромоводород, на нейтрализацию которого потребовалось 80 мл (р = 1,2 г/мл) раствора с массовой долей гидроксида натрия 20 %. Определите структурную формулу арена. Название его, если известно, что при бромировании в указанных условиях образуется только 1 изомер монобромпроизводного. 19. Отношение молярных масс монохлорпроизводного алкана и полученного из него при действии водного раствора щелочи спирта равно 1,578. Установите формулу галогеналкана. 20. 30 г моноаминомонокарбоновой кислоты прореагировало с 16 г гидроксида натрия. Назовите исходную кислоту. 21. При сжигании 6,9 г газа, плотность которого (н.у.) 2,054 г/л, получено 13,2 г оксида углерода (IV) и 8,1 воды. Определите структурную формулу данного вещества. 22. Смесь этиленового углеводорода и водорода пропустили над платиновым катализатором. При этом реакция прошла с выходом 80 %, и объем смеси уменьшился на 4,48 л (н.у.). При пропускании такого же количества исходной смеси через колбу с бромной водой весь углеводород прореагировал, и масса содержимого колбы увеличилась на 10,5 г. Установите формулу исходного алкена. 23. При сгорании 44,5 г органического соединения выделилось 31,5 г воды и 39,2 л (н.у.) газа. Газ был пропущен через избыток раствора гидроксида натрия, при этом его объем уменьшился в 7 раз. Определите число изомеров, которое может иметь данное соединение, учитывая, что оно способно вступать в реакции с соляной кислотой и раствором гидроксида натрия. 24. Смесь равных количеств двух различных алканов имеет плотность по водороду, равную 15. Установите формулы данных алканов. 25. При гидрировании алкена образовался алкан, массовая доля водорода в котором на 5,714 % больше, чем в исходном алкене. Определите формулу алкена. 26. В некотором органическом веществе массовая доля углерода равна 85,71 %, водорода – 14,29 %. 42 г этого вещества при температуре 127 0С и давлении 5 атм. занимают объем 3,28 л. Определите молекулярную формулу вещества. 27. При сгорании 2,3 г органического вещества образовалось 4,4 г углекислого газа и 2,7 г воды. 2,3 г паров сгоревшего вещества при температуре 40 0С и давлении 1,5 атм. занимают объем 0,855 л. Определите молекулярную формулу вещества.
Примеры решения контрольных задач: ПРИМЕР 1 Найдите молекулярную формулу углеводорода, если известно содержание в нем углерода w(%) и плотность вещества.
ПРИМЕР 2 Массовые доли углерода, водорода и кислорода в некотором веществе равны 40,00, 6,67 и 53,33 % соответственно. Плотность паров этого вещества по водороду равна 30. Установите молекулярную формулу вещества. Решение. Массы элементов в 100 г вещества равны: m(С) = 40,00 г, m(Н) = 6,67 г, m(О) = 53,33 г. Числа молей атомов данных элементов относятся друг к другу как:
Чтобы получить простейшее целочисленное отношение, разделим полученные числа на меньшее из них:
Простейшая формула вещества: СН2O. Зная плотность паров вещества по водороду, рассчитаем молекулярную массу вещества: Мг(газа) = Мг(Н2) * DН2(газа) = 2 * 30 = 60. Молекулярная масса, вычисленная для простейшей формулы, М(СН2O) = 12 + 2 + 16 = 30, что в 2 раза меньше, чем истинная молекулярная масса вещества. Поэтому индексы в простейшей формуле нужно удвоить: С2Н4O2 – молекулярная формула.
ПРИМЕР 3 Вещество состоит из углерода, водорода и хлора. При сжигании 0,956 г его получено 0,352 г углекислого газа и 0,0720 г воды. Молекулярная масса вещества 119,5г/моль. Найти его формулу. Решение. Пусть вещество имеет формулу CxHyClz. Запишем схему реакции сгорания этого вещества: CхHуClz, + O2 → СO2 + Н2O + С12 Из схемы видно, что все атомы углерода из CxHyClz переходят в СO2, а все атомы водорода – в молекулы воды Н2O. Находим количества вещества СО2, Н2О: n(CO2) = m(CO2) / M(CO2) = 0,352 / 44 = 0,008 моль; n(H2O) = m(H2O) / M(H2O) = 0,0720 / 18 = 0,004 моль. Находим число атомов углерода и водорода: n(С)=n(СO2)=0,008 моль; n(Н)=2n(Н2O)=2 * 0,004=0,008 моль. Массы элементов углерода и водорода в исходном веществе: m(С)=n(С) · М(С)=0,008 *12=0,096 г; m(H)=n(Н) ·M(H)=0,008 * 1=0,008 г. Находим массу и число атомов хлора в веществе: m(С) + m(Н)=0,096 + 0,008=0,104 г; m(С1)=m(в-ва) – 0,104=0,956 – 0,104=0,852 г; n(Cl)=m(Cl) / M(Cl) = 0,852 / 35,5=0,024 моль. Простейшее целочисленное отношение чисел молей атомов в данном веществе равно: n(С) : n(Н) : n(С1)=0,008 : 0,008 : 0,024=1:1:3. Простейшая формула вещества: СНС13. Молекулярная масса простейшей формуле, Мr(СНС13)=12 + 1 + 3 × 35,5=119,5, что совпадает с приведенной в условии молекулярной массой вещества. Таким образом, молекулярная и простейшая формулы идентичны.
ПРИМЕР 4 Определите массу раствора гексановой кислоты с массовой долей 50%, необходимой для нейтрализации щелочи NaOH количеством 8моль.
Решение: Составим уравнение реакции: С5Н11СООН + NaOH = С5Н11СООNa + Н2О По уравнению реакции на1 моль щелочи требуется 1 моль кислоты, значит на 8 моль щелочи потребуется 8 моль кислоты. Масса 8 моль кислоты: 8 * 116 = 928 г где 116-молярная масса кислоты (г/моль) массу раствора кислоты определяем по формуле: mр-ра = (mв-ва / w ) * 100% mр-ра = (928 / 50 ) * 100% = 1856 г Ответ: масса раствора кислоты 1856г.
ПРИЛОЖЕНИЕ
Таблица 1. Важнейшие одноосновные карбоновые кислоты
Таблица 2. Строение некоторых аминокислот
|