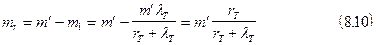ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Краткие теоретические сведения.
Лабораторная работа № 8. Исследование процесса получения твердого азота При вакуумировании парового пространства
Цель работы - изучить процесс самозамораживания криоагентов; получить твердый азот; определить потери массы криоагентов на его охлаждение и замораживание; рассчитать с учетом внешних теплопритоков расход криоагента при самозамораживании. Оборудование- механический вакуумный насос; прозрачный вакуумный колпак; стеклянный сосуд для криоагента с указателем уровня; вакуумная панель с герметичным разъемом и вакуумными вводами; вентили; магистраль откачки; вакуумметр; измеритель температуры.
Краткие теоретические сведения. В зависимости от термодинамических условий одно и тоже вещество может находиться в газообразном, жидком и твердом состояниях, причем эти состояния (фазы) могут существовать одновременно, находясь в контакте друг с другом. Фазой называется «термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний (других фаз) того же вещества…» Свойства твердых криоагентов в большой степени зависят от способа их получения, основные способы отвержения криоагентов следующие: - дросселирование жидкости до давления, меньшего, чем давление в тройной точке на фазовой диаграмме состояния; - изотермическое сжатие жидкости с последующим изоэнтропным ее расширением; - барботаж неконденсирующегося при рабочих температурах газа через слой замораживаемой жидкости; - замораживание жидкости посторонним криоагентом, имеющим температуру ниже равновесной температуры отвердения замораживаемого вещества; - вакуумирование парового пространства над жидкостью в закрытом сосуде (самозамораживание). Преимуществами последнего способа являются его простота и высокая производительность, недостатками - пористость получаемого твердого криоагента и необходимость восполнения убыли криоагента, происходящей вследствие откачки его паров. Отвердение криоагентов с помощью откачки паров над жидкой фазой протекает в три этапа: 1) охлаждение криоагента до температуры тройной точки (ТТТ); 2) затвердевание жидкости при ТТТ; 3) охлаждение твердой фазы ниже ТТТ.
Рис. 1а Рис. 1б На диаграмме Из фаз правила следует, что у химически индивидуального вещества (однокомпонентная система) при равновесии не может быть больше трёх фаз. Эти три фазы для азота - твёрдая, жидкая и газообразная. Равновесие более чем трёх фаз одного и того же вещества невозможно. На диаграмме
На первом и втором этапах процессы самозахолаживания и замораживания идут за счет выкипания части жидкости для восстановления равновесия в системе жидкость - пар или шуга - пар. В момент достижения ТТТ на поверхности жидкости появляется пленка твердой фазы для азота это набор отдельных кристаллов с хорошо с различимой макроскопической гексагональной симметрией и размером около 10 мм. Впоследствии пленка твердой фазы утолщается (преимущественно вдоль границ, образующих ее кристаллов в виде мелкозернистых дендритов), что ведет к снижению отвода паров с поверхности жидкости и падению давления над слоем твердой фазы. Возникший градиент давления деформирует слой твердой фазы, отрывает его от поверхности жидкости, на которой образуется новый слой твердого криоагента. Такому течению процесса способствуют высокая скорость откачки и большая поверхность зеркала жидкости. Образование нескольких слоев твердой фазы уменьшает скорость отвода паров и препятствует дальнейшим отрывам, которых можно избежать и вовсе, если удерживать образовавшуюся твердую фазу механически (например, металлической сеткой) или если снизить скорость откачки. После прекращения отрывов происходит утолщение твердой фазы книзу, а сцепление первых слоев со стенками сосуда препятствует перемещению твердого криоагента (если его плотность отличается от плотности жидкой фазы). В период затвердевания оставшейся части жидкости понижение верхнего уровня твердой фазы (вследствие сублимации) незначительно. С ростом толщины слоя отвердевшего криоагента фронт кристаллизации теряет плоскую форму, приобретая колоколообразную. Более быстрое продвижение его у стенок сосуда связано, по-видимому, с влиянием отвода паров через пристенные щели, вследствие чего фазовый переход у стенки происходит при постоянном подводе жидкости и здесь твердый криоагент не имеет видимых пор, в то время как в центре сосуда отвердевший криоагент приобретает рыхлую структуру с большим количеством макроскопических пор, что является следствием парообразования на фронте кристаллизации, и микрокапилляров, идущих в направлении откачки и образующихся в результате выхода пузырьков пара. Физическая сущность метода самозамораживания жидкости состоит в следующем: при адиабатической откачке замкнутого объема с некоторым количеством жидкости понижается давление паров над ее поверхностью, нарушается динамическое равновесие системы жидкость - пар, на восстановление которого (т. е. на испарение требуемого для достижения равновесного состояния количества вещества) тратится определенное количество теплоты, и когда равновесие между фазами будет установлено, начальная фаза (жидкость) будет иметь меньшую энтальпию и соответственно более низкую температуру. Повторение или непрерывное поддержание процесса откачки с последующим или с текущим восстановлением равновесия в системе жидкость - пар ведет к снижению энтальпии системы вплоть до полного самозамораживания жидкой фазы. Удельное количество теплоты, которое следует при этом отвести от жидкости, можно определить как сумму изменения энтальпии системы и теплоты фазового превращения
где D T = T0 - TФ; Т0 -начальная равновесная температура вещества, К; ТФ - температура фазового перехода, К;
Когда в закрытом сосуде устанавливается динамическое равновесие, тогда в каждый момент времени количество молекул, переходящих из жидкости в пар и из пара в жидкость, равны; соответственно устанавливаются определенное давление насыщенного пара в сосуде и температура, одинаковая для обеих фаз. Теплоты фазового перехода при испарении и конденсации равны. При вакуумировании парового пространства, т.е. при удалении некоторой части молекул пара динамическое равновесие системы жидкость - пар нарушается: понижается давление пара, в единицу времени из жидкости в пар переходит больше молекул, чем из пара в жидкость. Следовательно, и количество теплоты, поглощенное в единицу времени испаряющейся жидкостью, будет больше количества теплоты, выделенного конденсирующимся паром. Поскольку процесс идет в адиабатических условиях, на испарение требуемого для восстановления равновесия количества жидкости тратится ее собственная энтальпия. Таким образом, при вакуумировании парового пространства температура жидкости понижается вплоть до ТТТ. В дальнейшем жидкость самозамораживается, причем характер понижения давления при постоянной скорости откачки изменяется в зависимости от образования и роста кристаллов твердого азота. Если продолжать откачку, то после полного затвердевания всей жидкости температура твердого тела будет продолжать понижаться вследствие вынужденной сублимации, стремясь в пределе к абсолютному нулю температур. При вакуумировании парового пространства в изолированном от натекания и внешних теплопритоков сосуде, когда за бесконечно малое время dt откачивается количество пара, равное dm, температура оставшейся жидкости понижается на dТ градусов. Тогда из уравнения энергетического баланса системы жидкость - пар
где m0 - масса жидкого криоагента в сосуде перед началом откачки, кг; r (Т) - удельная теплота парообразования, Дж/кг; С учетом того, что для большинства криоагентов (в том числе и для азота) зависимости теплоемкости С5 и теплоты парообразования r от температуры с погрешностью , не превышающей 5 %, можно принять линейными и использовать в расчетах средние их значения в интервале температур dТ, уравнение (8.2) можно записать как
Левая часть уравнения (8.3) представляет собой количество теплоты, на которое уменьшилась энергия оставшейся в сосуде жидкости за время dt; правая - количество теплоты, отведенное за это же время из системы вместе с откачанным паром. Преобразовав уравнение (8.3), получим
За конечное время t из сосуда будет откачено Sd m пара, что приведет к понижению температуры оставшейся жидкости на SdТ градусов, и уравнение (8.4) запишется в виде:
где n - число интервалов, на которые разбит процесс откачки. Учитывая, что Sd m= m0-m¢, где m¢ -масса жидкости, оставшейся в сосуде к моменту достижения ТТТ, получаем
отсюда определяем массу жидкости, оставшейся в сосуде при достижении ТТТ,
Дальнейшее вакуумирование парового пространства над достигшей тройной точки жидкостью ведет к затвердеванию части жидкости за счет теплоты испарения откачанной. В этом случае для адиабатических условий процесс характеризуется уравнением энергетического баланса:
где m¢ - масса жидкости в сосуде при ТТТ [из уравнения ( 8.7 )], кг; m1 -масса откачанного пара, кг; lT - удельная теплота кристаллизации при ТТТ, Дж/кг; x - доля твердой фазы ; rT - удельная теплота парообразования при ТТТ, Дж/кг. Левая часть уравнения (8.8) соответствует уменьшению количества теплоты жидкости, находящейся при температуре тройной точки, при образовании доли твердой фазы, равной x; правая - количеству теплоты, отведенному из системы с откачанным паром. Для случая полного затвердевания (x = 1) какой-то массы жидкости азота m количество пара, которое необходимо откачать из сосуда, можно определить из (8.8):
тогда массу отвердевшего азота можно определить как разность между начальной массой жидкости, достигшей ТТТ, и массой откачанных паров, т.е.
(при получении этого уравнения не учитывается масса криоагента, находящегося в паровом пространстве). Из уравнений (8.7) и (8.10) можно определить количество твердого криоагента, которое получено путем откачки его паров, начиная от атмосферного давления. Отбор теплоты в процессе охлаждения и кристаллизации происходит главным образом путем образования и отвода паров вблизи фронта фазового превращения, а перенос теплоты посредством теплопроводности осуществляется лишь в узкой зоне твердой фазы на ее границе с жидкостью. Таким образом, при небольших скоростях откачки теплоемкостью отвердевшего криоагента можно пренебречь, считая его охлаждение незначительным. В уравнениях (8.2) и (8.8), полагая процесс адиабатичным, пренебрегаем количеством теплоты Q0, вносимым в систему с внешними теплопритоками, которые обусловлены, в основном, излучением. х величину можно определить после того, как весь оставшийся в сосуде криоагент будет переведен в твердое состояние. Если после этого перекрыть магистраль откачки, то можно наблюдать переход криоагента из твердого состояния в жидкое за счет внешних теплопритоков Q0, и их величина Q0 = lT mT, ( 8.11 ) где lT - удельная теплота кристаллизации при ТТТ, Дж/кг; mT - масса твердого криоагента, кг. При известном времени t , за которое происходит полный переход из твердой фазы в жидкую, мощность внешнего теплопритока излучением
Поскольку отвержденные криоагенты применяются, в основном, в сублимационных аккумуляторах холода (САХ) для работы в космических аппаратах (причем космическое пространство является в этом случае вакуумным насосом с неограниченным ресурсом работы, поддерживающим САХ на заданном температурном уровне), изучение количественных характеристик процессов получения твердых криоагентов вакуумированием парового пространства имеет существенное значение. |





 тройная точка изображается изолированной точкой, являющаяся точкой пересечения кривых равновесия каждых двух из трёх фаз (рис.1а области
тройная точка изображается изолированной точкой, являющаяся точкой пересечения кривых равновесия каждых двух из трёх фаз (рис.1а области  ,
,  ,
,  - области трёх однородных фаз).
- области трёх однородных фаз). (под
(под  понимается удельный объем, т.е. объём единицы массы вещества:
понимается удельный объем, т.е. объём единицы массы вещества:  ,
,  - плотность вещества в данной фазе) окрестность тройной точки имеет вид изображенный на рис.1б, где заштрихованные области - области попарного равновесия фаз; удельные объёмы трёх фаз, находящихся в равновесии в тройной точке определяются абсциссами точек 1, 2, 3.
- плотность вещества в данной фазе) окрестность тройной точки имеет вид изображенный на рис.1б, где заштрихованные области - области попарного равновесия фаз; удельные объёмы трёх фаз, находящихся в равновесии в тройной точке определяются абсциссами точек 1, 2, 3.
 средняя удельная теплоемкость жидкости на линии насыщения в интервале температур D T, Дж/(кг К);
средняя удельная теплоемкость жидкости на линии насыщения в интервале температур D T, Дж/(кг К); средняя теплота фазового превращения в интервале температур DТ, Дж/кг.
средняя теплота фазового превращения в интервале температур DТ, Дж/кг.