 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Краткая теоретическая часть 12
ИССЛЕДОВАНИЕ КИСЛОТНО-ОСНОВНЫХ РАВНОВЕСИЙ В ВОДНЫХ РАСТВОРАХ КОНДУКТОМЕТРИЧЕСКИМ МЕТОДОМ Методические указания к лабораторной работе по курсам «Физическая химия» и «Дополнительные главы физической химии» для студентов, обучающихся по программе бакалавриата по направлениям подготовки 240700 − Биотехнология 240100− Химическая технология
УДК 66.092-977(075.8) ББК 35.5я73
Составитель Степановских Е.И.
ИССЛЕДОВАНИЕ КИСЛОТНО-ОСНОВНЫХ РАВНОВЕСИЙ В ВОДНЫХ РАСТВОРАХ КОНДУКТОМЕТРИЧЕСКИМ МЕТОДОМ: лабораторная работа / Екатеринбург: УрФУ, 2014. −16 с.
Рассмотрена лабораторная работа по разделу курсов «Физическая химия» и «Дополнительные главы физической химии». Описание экспериментальной части лабораторной работы соответствует изданному ранее пособию [1], однако работа существенно переработана в связи с новыми рабочими планами специальностей и использованием нового оборудования. К ней добавлено расчетное аналитическое задание, выполнение которого позволит исследовать вещества, по каким-либо причинам (дефицитность, ядовитость и т.д.) не применяемые в студенческом лабораторном практикуме. В конце указаний приведена многовариантная задача и необходимые справочные материалы.
Библиогр.: 4 назв. Рис.3. Прил
© Уральский федеральный университет, 2014 Цели работы Ознакомиться с кондуктометрическим методом исследования ионных равновесий в водных растворах слабых кислот и определить, согласно различным вариантам заданий, требуемую константу ионизации. Варианты заданий А. Определение константы кислотности слабой кислоты НА и константы основности сопряженного с ней основания А- по электропроводности водного раствора кислоты. Б. Расчет величины константы кислотности слабой кислоты НА и константы основности сопряженного с ней основания А- по известным экспериментальным данным. Краткая теоретическая часть Равновесие в растворах электролитов, через которые не проходит электрический ток, является динамическим, усредненным по времени и по объему. Частицы раствора все время совершают хаотическое движение и перескакивают с одного места на другое. В среднем все движения частиц скомпенсированы и направленного макроскопического перехода ионов и диполей в каком-либо направлении не происходит. Направленное передвижение ионов можно вызвать следующими причинами: 1. Изменение активности растворенного вещества в одной части раствора по отношению к другой. Это наблюдается, например, при электролизе: вблизи электрода концентрация может быть больше, чем в растворе. Идет самопроизвольный процесс выравнивания концентраций - диффузия. 2. Наложение электрического поля, которое вызывает направленное перемещение частиц – миграцию. Ион движется как под действием градиента химического потенциала так и под действием градиента электрического потенциала, а общей силой действующей на ион является градиент электрохимического потенциала. При изучении электропроводности целесообразно использовать переменный ток, тогда при движении заряженных частиц под действием электрического поля не будет возникать градиент химического потенциала и тогда диффузию можно не учитывать. Электрическая проводимость (электропроводность) – это мера способности веществ проводить электрический ток. Это величина, обратная электрическому сопротивлению. Удельная электропроводность (æ, каппа) − это величина, обратная удельному сопротивлению ( Молярная электропроводность (l, лямбда). равна удельной электропроводности, деленной на концентрацию Иногда используют эквивалентную электропроводность, которая равна удельной электропроводности, деленной на эквивалентную концентрацию ионов.
Эквивалентную концентрацию ионов можно найти, умножив концентрацию электролита на число данного иона в молекуле электролита ni и на абсолютное значение его заряда zi.
При рассмотрении электропроводности растворов электролитов используют понятия скорости движения различных ионов
Вводится также понятие - подвижность частиц вида i или ионная электропроводность (эквивалентная электропроводность)
где F – число или постоянная Фарадея (или мольный электрический заряд) , F = 96485 Кл/моль. Удельную электропроводность раствора с протекающими в нем r реакциями, в которых образуется i ионов, можно найти по формуле: æ = Рассмотрим, например, как можно найти электропроводность водного раствора слабого основания B. Учтем две реакции: 1. Н2О + Н2О = Н3О+ + ОН- (6) 2. В + Н2О = ВН+ + ОН- . (7) За счет протекания этих реакций в растворе будут находиться ионы H3O+, OH− , BH+. Электропроводность раствора будет равна æ где
где Подстановка соотношений (9) в уравнение (8) приводит к выражению , связывающему удельную электропроводность раствора с плотностями глубин протекающих в растворе реакций æ Если концентрация электролита мала, т.е. Закон независимого движения ионов или закон Кольрауша: при бесконечном разведении в растворе электролита ионы переносят электрический ток независимо друг от друга.
Из данных по измерению электропроводности раствора определенной концентрации можно найти степень электролитической диссоциации этого раствора
Электропроводность раствора при бесконечном разведении обычно находят по справочным величинам подвижностей ионов по формуле (11). Для большинства ионов величина подвижности находится в пределах (20-80)×10-4 Ом-1м2моль-1. Но существует два вида ионов, которые имеют аномально высокую подвижность: ионы гидроксония H3O+ и ионы гидроксила OH−. Это объясняется особым механизмом переноса заряда этими ионами в воде – так называемым, эстафетным механизмом. Ион гидроксония способен передавать протон ближайшей молекуле воды. Если тока нет, то перескоки протона равновероятны в разных направлениях. Но если наложено электрическое поле, то повышается вероятность перескоков протона к молекуле воды в направлении поля. Аномальную подвижность ионов гидроксила можно объяснить тем, что там протон перескакивает от молекулы воды к иону OH−. Но в молекуле воды протон связан более прочно, чем в ионе гидроксония, поэтому подвижность ионов гидроксила меньше, чем подвижность ионов гидроксония.
Зависимость электропроводности сильного электролита от концентрации обусловлена ион-ионным взаимодействием. Наличие ионной атмосферы приводит к двум эффектам торможения движения центрального иона. Релаксационное торможение связано с конечным временем разрушения (релаксации) ионной атмосферы. При движении центрального иона, ионная атмосфера в течение какого-то времени впереди иона не успевает образоваться, а сзади не успевает разрушиться. На центральный ион как бы действует электростатическая возвращающая сила, которая и замедляет его движение. Электрофоретическое торможение связано с тем, что ион под воздействием электрического поля передвигается не в неподвижной среде, а в потоке движущихся ему навстречу противоионов. Если сольватные оболочки катиона и аниона частично перекрываются, то при движении ионов в противоположных направлениях молекулы растворителя увлекаются за ними, что и вызывает этот эффект торможения. С учетом этих двух эффектов можно записать выражение для молярной (эквивалентной) электропроводности сильного электролита:
где Для 1,1-валентного электролита справедливо уравнение Онзагера :
где А и В - константы, зависящие от температуры, вязкости и диэлектрической проницаемости растворителя. На рис. 1 приведена графическая зависимость по уравнению (14), которая позволяет определить для сильных электролитов предельную электропроводность методом экстраполирования зависимости на нулевую концентрацию.
Вид зависимости удельной и эквивалентной электропроводностей от концентрации приведен на рис. 2 и 3. Сплошные линии на этих рисунках соответствуют слабому электролиту, пунктирные – сильному. Рост удельной электропроводности с ростом концентрации электролита на рис. 2 связан в начале с увеличением числа ионов. Наблюдаемое затем уменьшение электропроводности объясняется возрастанием роли второго эффекта, связанного с ростом концентрации - увеличения вязкости электролита. Из рис. 3. видно, что для слабого электролита графически невозможно определить величину предельной подвижности раствора, т.к. зависимость асимптотически приближается к оси. Значение предельных электропроводностей слабых электролитов находят линейной комбинацией подходящих реакций. Зависимость подвижности от температуры определяется уравнением где a- температурный коэффициент электрической проводимости (для сильных кислот 0,016, для сильных оснований 0,019 и для солей 0,022). Алгоритм выполнения задания А Методика проведения эксперимента В данной работе используют кондуктометры – специальные приборы, позволяющие определять сопротивление исследуемого раствора. Рассмотрим методику измерения удельной электропроводимости раствора при помощи анализатора жидкости серии Анион 4100 и датчика ДКВ. Для измерения удельной электропроводности растворов используется анализатор жидкости серии Анион 4100 (рис.4).
При включении прибора на экране измерений маркер может находиться в одной из четырех функциональных позиций. Необходимо перевести маркер кнопками “>” и “ <” во вторую позицию слева. Для измерения удельной электропроводности комбинированный выносной датчик (ДВК) должен быть погружен в раствор так, чтобы раствор полностью заполнял кондуктометрическую ячейку, а на внутренней поверхности ячейки при этом не было заметно пузырьков воздуха. Если пузырьки наблюдаются, то их необходимо удалить взбалтыванием раствора. При работе необходимо следить, чтобы во время фиксации результатов измерений расстояние между корпусом датчика и стенками сосуда было не менее 1 см.
Определение констант основности и кислотности осуществляется в результате измерения удельной электропроводности нескольких образцов растворов, отличающихся концентрацией исследуемого вещества. Для растворов кислот (задание А) используются растворы концентраций 10-100 моль/м3 . Образцы растворов для исследования готовят разбавлением исходного раствора в мерных колбах. Для этого рассчитанное количество исходного раствора с помощью пипетки помещают в мерную колбу, смешивают с водой и доводят объем раствора до метки. Объем исходного концентрированного раствора, необходимого для приготовления растворов заданного состава, рассчитывается по формуле:
где V – объем мерной колбы, в которой готовится раствор нужной концентрации; Результаты измерения электропроводностей заносятся в таблицу, примерная форма которой приведена далее.
Расчет значений констант кислотности и основности сопряженных кислоты и основания (НА и А-) Компонент (частица), отдающая протон, называется кислотой (HA, BH+). Компонент, принимающий протон, - основание ( B, A-). Компоненты HA и A-, BH+ и B - сопряженные кислота и основание. Обычно для определения константы кислотности 1. Н2О + Н2О = Н3О+ + ОН- х1 2. HA + Н2О = H3O+ + A- х2 Законы ионных равновесий можно представить в виде:
Составим балансовые уравнения для всех участников реакций:
Подстановка соотношений (18)−(21) в (16) и (17) приводит к
Если
Удельная электропроводность раствора, содержащего ионы i, находится по формуле (5). В водном растворе слабой кислоты, находятся следующие ионы: H3O+; OH− и A−. Удельная электропроводность исследуемой системы равна: æ или, после преобразования с учетом выражений (18)-(21) æ Плотность глубины реакции ионизации рассматриваемых в практикуме кислот гораздо больше, чем плотность глубины реакции автопротолиза воды æ Отсюда можно найти плотность глубины реакции ионизации слабой кислоты
Причем раз растворы разбавленные, то подвижности ионов практически равны предельным подвижностям
æ Измерив удельную электропроводность и найдя в справочных таблицах значения предельных подвижностей ионов, можно вычислить плотность глубины реакции ионизации кислоты, а затем, располагая ее значением, рассчитать величину константы кислотности. Образующийся при ионизации слабой кислоты анион A− вступает в протолитическое взаимодействие с водой А- + Н2О = НА + ОН-. На основе константы равновесия этой реакции вводится константа основности аниона A− , равная
Произведение константы кислотности слабой кислоты и константы основности сопряженного с ней основания равно ионному произведению воды ( для водных растворов). Величину константы основности сопряженного с данной кислотой основания, вычисляют из соотношения:
Алгоритм выполнения задания Б Студенту предлагаются полученные ранее экспериментальные данные по зависимости удельной электропроводности от концентрации растворов следующих кислот: бензойной, пропионовой, масляной и валериановой. Расчет констант кислотности и основности сопряженных кислоты и основания (НА и А-) проводят аналогично описанному ранее в алгоритме выполнения задания А. Далее приведены экспериментальные данные по разным вариантам задания Б. Температура опытов 298 К, давление 1 атм. Требуется вычислить среднее по пяти опытам значение константы кислотности и сравнить со справочной величиной.
12 |




 ) æ =
) æ =  , измеряется в Ом−1м−1.
, измеряется в Ом−1м−1. æ/
æ/  , измеряется в Ом-1×м2× моль-1.
, измеряется в Ом-1×м2× моль-1. . (1)
. (1) . (2)
. (2) , и абсолютной скорости движения иона
, и абсолютной скорости движения иона  под действием электрического поля напряженностью E, В/м
под действием электрического поля напряженностью E, В/м . (3)
. (3) , (4)
, (4) . (5)
. (5) , (8)
, (8) − равновесные концентрации ионов. Они рассчитываются с учетом протекания обоих реакций по следующим балансовым соотношениям:
− равновесные концентрации ионов. Они рассчитываются с учетом протекания обоих реакций по следующим балансовым соотношениям: ;
;  ;
;  , (9)
, (9) − плотности глубин реакций 1 и 2.
− плотности глубин реакций 1 и 2. . (10)
. (10) , то раствор называется предельной разбавленным. В бесконечно разбавленном растворе все характеристики носят дополнительное название «предельная»: предельная подвижность иона, предельная подвижность электролита.
, то раствор называется предельной разбавленным. В бесконечно разбавленном растворе все характеристики носят дополнительное название «предельная»: предельная подвижность иона, предельная подвижность электролита. . (11)
. (11) . (12)
. (12) 349,8∙10−4 (Ом∙моль) -1м 2;
349,8∙10−4 (Ом∙моль) -1м 2;  198,3∙10−4 (Ом∙моль) -1м 2.
198,3∙10−4 (Ом∙моль) -1м 2. , (13)
, (13) - эквивалентная электропроводность раствора сильного электролита при концентрации его с;
- эквивалентная электропроводность раствора сильного электролита при концентрации его с;  - электропроводность раствора при бесконечном разведении;
- электропроводность раствора при бесконечном разведении;  − уменьшение электропроводности раствора за счет ион-ионного взаимодействия, то есть за счет электрофоретического и релаксационного торможения движения ионов.
− уменьшение электропроводности раствора за счет ион-ионного взаимодействия, то есть за счет электрофоретического и релаксационного торможения движения ионов. , (14)
, (14)
 ; [a] = К-1 (15)
; [a] = К-1 (15) Управление работой прибора осуществляется с помощью клавиатуры и графического индикатора. Клавиатура прибора, изображенная на рис.5, кнопочная и содержит 13 кнопок – 12 функциональных и кнопку включения и выключения прибора.
Управление работой прибора осуществляется с помощью клавиатуры и графического индикатора. Клавиатура прибора, изображенная на рис.5, кнопочная и содержит 13 кнопок – 12 функциональных и кнопку включения и выключения прибора. Результаты измерений удельной электропроводности появятся на экране, внешний вид которого приведен на рис.6.
Результаты измерений удельной электропроводности появятся на экране, внешний вид которого приведен на рис.6. ,
,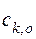 и
и  – концентрация кислоты в исследуемом растворе и в исходном (концентрированном) растворе соответственно.
– концентрация кислоты в исследуемом растворе и в исходном (концентрированном) растворе соответственно. слабой кислоты HA рассматривают следующие линейно независимые реакции (справа указаны плотности глубин этих реакций):
слабой кислоты HA рассматривают следующие линейно независимые реакции (справа указаны плотности глубин этих реакций): ; (16)
; (16) . (17)
. (17) ; (18)
; (18) ; (19)
; (19) ; (20)
; (20)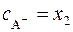 . (21)
. (21) ; (22)
; (22) . (23)
. (23) , то
, то  , и уравнения (22) и (23) можно упростить
, и уравнения (22) и (23) можно упростить ; (24)
; (24) . (25)
. (25) (26)
(26) . (27)
. (27)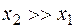 , то
, то  , и уравнение (27) преобразуется к виду
, и уравнение (27) преобразуется к виду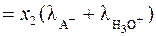 . (28)
. (28) æ/
æ/ 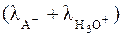 . (29)
. (29) . Система уравнений, получаемая после всех разумных допущений, имеет вид:
. Система уравнений, получаемая после всех разумных допущений, имеет вид: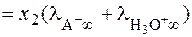 . (31)
. (31)
 . (32)
. (32) . (33)
. (33)