 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Окислительно - восстановительные (ОВ) гальванические элементы 12
Особенностью данных элементов является то, что окислительно - восстановительный процесс протекает только в растворах. Оба электрода являются инертными, или пассивными, т.е. сами они не принимают участия в ОВ процессах, а выполняют роль проводников электронов.
Электрохимические реакции очень медленные. Для ускорения процессов Суть топливных элементов заключается в том, что электроды являются одновременно и катализаторами. Топливо, т.е. восстановитель и окислитель, хранится вне гальванических элементов и подаётся на электроды по мере необходимости, рис.5.
Рис.5 Электроды выполняются из пористого Ni или пористой Pt, то есть тех металлов, которые являются катализаторами электродных процессов. В качестве электролита используется раствор гидроксида калия.
в результате которой химическая энергия непосредственно превращается в электрическую. Пример применения топливных элементов - использование их в мобильниках фирмы Toshiba. lib.ssga.ru›fulltext/UMK/AUUMK/Новая папка/Химия… копия ещё Измерения рН относятся к наиболее распространенным измерениям в химии. Правильные названия для рН – водородный показатель, показатель кислотности, «пэ-аш». В ангилйском языке говорят «пи-эйч», в немецком «пэ-ха», в болгарском «пэ-хаш». Недоученные менеджеры некоторых российских торговых компаний говорят «эр-эн», это неправильно и является для образованных людей предметом насмешек. Официальное определение дается уравнением: рН= -lg aH+, (1) где aH+- термодинамическая активность или действующая концентрация ионов водорода. Поправочный множитель γ, связывающий концентрацию и активность называется коэффициентом активности: aH+ = γ[H+], (2)
Таким образом, рН - метр представляет собою милливольтметр. Особенностью такого милливольтметра является очень маленький входной ток, так что он может измерять напряжение с самых разных электродов, в том числе стеклянных, через который большой ток не проходит. Кроме того, у рН-метра имеется система пересчета напряжения в рН (а в более совершенных моделях и в некоторые другие величины, например в градусы Тернера для кислотности молока). Рассмотрим более подробно работу рН-метра. В раствор опускают два электрода: индикаторный (измерительный) и электрод сравнения. Потенциал индикаторного электрода относительно раствора линейно зависит от величины рН раствора (это объясняется ниже): Uизм = а + b*pH (3) Здесь а и b - константы, зависящие только от температуры. В идеале потенциал индикаторного электрода не зависит от присутствия других ионов. Это называется селективностью индикаторного электрода к ионам водорода. Таким образом, рН-электрод относится к ионоселективным электродам. Полезный сигнал (зависимость от рН раствора) возникает на границе раздела фаз мембрана индикаторного электрода-раствор, передается на металлический проводник, входящий в конструкцию индикаторного электрода и подается на вход рН-метра, который, как уже отмечалось выше, представляет собою специализированный вольтметр. Однако вольтметр не может измерить потенциал одного электрода. Он должен измерять напряжение, то есть разность потенциалов двух электродов. Поэтому необходим еще электрод сравнения, потенциал которого подается на второй вход рН-метра. Электрод сравнения служит нулем отсчета. Это устройство, которое поддерживает постоянную величину разности потенциалов между своим выходом (который подключается на вход рН-метра) и точкой в растворе, куда погрузили его рабочую часть. Его потенциал относительно раствора не зависит от присутствия других ионов в растворе и вообще от состава раствора. Это целое устройство, использующее значительное количество научных и технических приемов. Если мы опускаем электрод сравнения в раствор, то между точкой в растворе, куда он погружен и его выходом возникает постоянное напряжение Uсравн. Это напряжение подается на второй вход рН-метра (вход сравнения). Падение напряжения в растворе равно нулю, так как никакой ток в растворе не протекает (а если протекает, то он мешает измерению рН). Таким образом, напряжение между входами рН-метра, то есть измеряемая величина, определяется выражением: DU = Uизм - U сравн = а + b*pH - U сравн = с + b*pH (4) Таким образом, между измеряемой рН-метром величиной напряжения и значением рН раствора возникает линейная связь. Константы с и b для данной электродной системы определяют с помощью стандартных растворов с известной величиной рН (привязанных к Государственному эталону, где шкала рН определяется из комплекса теоретических и экспериментальных данных). Эти константы фиксируют в памяти компьютера. После этого прибор способен автоматически пересчитывать измеренную величину DU в значение рН раствора, например, при массовых измерениях или при непрерывном наблюдении за рН водопровода, реки или какого-то технологического раствора. В том числе прибор можно запрограммировать так, чтобы он управлял клапанами подачи кислоты или щелочи и выставлял заданную величину рН технологического или иного раствора (рН-стат). Как работает измерительный рН-электрод.
Рассмотрим подробнее работу рН-чувствительного электрода, проследим, откуда возникает соотношение (3). Конструктивно рН-электрод выполняют в виде стеклянной трубки, один конец которой заканчивается тонкостенным стеклянным шариком. С другого конца в трубку погружают серебряную проволоку, покрытую плотным слоем хлорида серебра. Трубку заливают 0,1 М раствором соляной кислоты, так что кислота полностью, без пузырей заполняет шарик и проволока глубоко погружена в раствор соляной кислоты. Пузыри в шарике препятствуют работе рН-электрода, нарушают контакт между проволокой и стеклянной мембраной, который осуществляется через раствор соляной кислоты. Поэтому «неработающий» рН-электрод иногда достаточно встряхнуть (для удаления внутренних пузырей), чтобы он заработал.
Обозначим разность потенциалов между Ag и AgCl DU1, между AgCl и HCl (0,1 M) DU2, между HCl (0,1 M) и внешним раствором DU3. С другой стороны, металлическое серебро, это кристаллическое тело, где в узлах кристалла находятся ионы серебра, а между ними распределен электронный газ. Таким образом. ионы серебра присутствуют в достаточном количестве в обеих фазах и именно их быстрый межфазный обмен приводит к равновесию, которое обеспечивает стабильность DU1 при фиксированной температуре. Таким образом, DU1 является константой. Разность потенциалов между AgCl и HCl (0,1 M) определяется равновесием, связанным с обменом на этой границе ионами Cl-. В растворе устанавливается динамическое равновесие, определяемое произведением растворимости хлорида серебра. Сколько хлорида переходит в раствор, столько и выпадает из раствора соляной кислоты. Потенциалопределяющая реакция может быть записана следующим образом: Cl- в хлориде серебра ↔ Cl- в соляной кислоте (6) Величина разности потенциалов в этом случае может быть выражена известным уравнением Нернста: DU2 = DU20 + (RT/F) ln ([Cl-]в хлориде серебра/[ Cl-]в соляной кислоте) (7) Здесь DU2 – разность потенциалов между хлоридом серебра и соляной кислотой при концентрации хлорида в кислоте 0,1 моль/л, DU20 – разность потенциалов между хлоридом серебра и соляной кислотой при концентрации хлорида в кислоте 1 моль/л (стандартная), R, T и F – соответственно универсальная газовая постоянная, абсолютная температура и число Фарадея. Поскольку действующая концентрация хлорида в хлориде серебра постоянна от природы, а в соляной кислоте постоянна за счет того, что трубка закрыта и не обменивается веществом с внешним пространством, значит постоянно и их отношение и логарифм отношения: DU2 = const. Это разность потенциалов на стеклянной мембране. Материал мембраны выбирается таким образом, что это стекло пропускает ионы водорода и не пропускает других ионов. Многочисленные экспериментальные исследования показали, что эта разность потенциалов определяется уравнением: DU3 = (RT/F) ln ([H+]внешн /[ H+]в соляной кислоте) (8) Строгой теории для объяснения этого факта до настоящего времени не существует, хотя и существует несколько объяснений. Логарифм отношения равен разности логарифмов: DU3 = (RT/F) ln ([H+]внешн ) - (RT/F) ln [ H+]в соляной кислоте) (9) Второе слагаемое в правой части уравнения (9) не зависит от состава внешнего раствора, поэтому мы можем считать его константой. Таким образом, суммарный потенциал рН-электрода относительно раствора рассчитывается как: Uизм = DU1 +DU2+DU3=DU1 +DU2 - (RT/F) ln [ H+]в соляной кислоте) + (RT/F) ln ([H+]внешн) = Таким образом. доказывается соотношение (3). Здесь введены обозначения: а= DU1 +DU2 - (RT/F) ln [ H+]в соляной кислоте) и b =-(RT/F) *2,303. При выводе также использовано тождество для перехода от натуральных логарифмов к десятичным: lnx = 2,303 lgx. 12 |





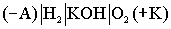 .
. .
. .
. ,
,