 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Восстановление гидридами бора и алюминия
Лекция 4 Гидрогенолиз
Гидрогенолизом называется расщепление связи углерод-гетероатом или гетероатом-гетероатом в условиях реакции гидрирования. Так, например, основание Шиффа, полученное из бензиламина и циклогексанона, в мягких условиях гидрируется до вторичного амина.
В более жестких условиях происходит гидрогенолиз связи C-N, и образуется первичный амин.
Гидрогенолизу обычно подвергаются аллил- и бензиламины, соответствующие спирты и простые эфиры.
Гидрогенолиз может происходить также в случае связей C-Hal, N-N, C-S, N-O, O-O и даже C-C (в малых циклах). Например, гидрирование эфира бензойной кислоты нельзя остановить на стадии образования бензилового спирта, поскольку гидрогенолиз последнего происходит гораздо легче гидрирования сложного эфира.
В ряде случаев гидрогенолиз является фактором, осложняющим синтез, но иногда он полезен. Например, он используется для удаления защитной бензилоксикарбонильной группы.
Для проведения гидрогенолиза бензильных производных чаще всего используют такие катализаторы, как палладий на угле и хромит меди, так как на этих катализаторах гидрирование ароматического кольца идет медленно. Напротив, свести гидрогенолиз к минимуму позволяют такие катализаторы, как родий и рутений.
Гидрогенолиз не происходит также при проведении реакций гидрирования в присутствии гомогенных катализаторов, о которых скажем ниже. Легкость гидрогенолиза связи C-Cl используют при восстановлении хлорангидридов кислот по Розенмунду.
Серу и хинолин добавляют с целью «отравить» катализатор, то есть сделать его менее активным. Заметим, что гидрогенолиз связи C-Cl в данном случае идет намного легче, чем восстановление карбонильной группы в альдегиде. Это достигается именно «отравлением» катализатора. Наиболее часто применяемые каталитические «яды» - это ртуть, сера, амины. Они образуют достаточно прочные связи с поверхностью катализатора, закрывая таким образом его активные центры. Гомогенное гидрирование Некоторые комплексы переходных металлов также способны катализировать гидрирование алкенов и алкинов. Поскольку эти комплексы растворимы в органических растворителях, то есть субстрат и катализатор находятся в одной фазе, такое гидрирование называется гомогенным. Приведем два примера катализаторов гомогенного гидрирования: (Ph3P)3RhCl (катализатор Уилкинсона) и IrCl(CO)(Ph3P)2 (катализатор Васка). Механизм гомогенного гидрирования включает в себя следующие этапы: координацию молекулы водорода с атомом металла (1), замещение одного из фосфиновых лигандов на алкен (образование π-комплекса, 2), внедрение алкена по связи металл-водород (3) и элиминирование продукта гидрирования (4).
Алкины при этом гидрируются быстрее алкенов, а вот группы COOR, NO2, CN, C(O)R не затрагиваются, например:
В данной реакции в качестве растворителя использован кетон, который, также как и группа NO2, в этих условиях не восстанавливается. При гидрировании альдегидов нежелательной реакцией является декарбонилирование. Эта реакция может быть подавлена проведением гидрирования в этаноле в качестве растворителя. Важным преимуществом гомогенного гидрирования по сравнению с гетерогенным является отсутствие гидрогенолизасвязейC-OиC-Nв бензильных производных.Преимуществамигомогенного гидрирования по сравнению с гетерогенным являются также лучшая воспроизводимость результатов, высокая селективность и нечувствительность к каталитическим ядам. Процесс весьма избирателен по отношению к двойным связям углерод-углерод разного типа. Это видно из приведенного ниже примера по гидрированию разных алкенов в присутствии катализатора Уилкинсона.
Использование хиральных лигандов позволяет проводить асимметрическое гидрирование С=С, C=O или C=N связей. Один из наиболее известных хиральных лигандов, используемых для этой цели − 2,2’-бис(дифенилфосфино)-1,1’-бинафтил (BINAP).
Гомогенное гидрирование можно проводить в двухфазной системе. При этом в качестве катализатора используется соль K3[Co(CN)5H]. Эта соль с помощью катализатора межфазного переноса переводится в органическую фазу, где и катализирует гидрирование.
Восстановление гидридами бора и алюминия
Косвенный метод гидрирования ненасыщенных соединений, ставший классическим благодаря работам Г. Брауна, заключается во взаимодействии алкенов и алкинов с гидридами бора (гидроборирование).
Гидроборирование
Диборан, необходимый для этой реакции, в лаборатории обычно получают взаимодействием борогидрида натрия с эфиратом трехфтористого бора.
В настоящее время можно приобрести готовый разбавленный раствор борана в ТГФ (его хранят при 0°С). Этот реагент весьма активен, но крайне огнеопасен. Можно использовать также комплексы борана с аминами R3N·BH3 (жидкости или кристаллические вещества). Эти комплексы удобны тем, что они неогнеопасны, однако они реагируют с алкенами лишь при повышенной температуре (100 оС). Применение находит также комплекс BH3·SMe2. Реакция диборана с алкеном происходит как согласованное син-присоединение к двойной углерод-углеродной связи:
Если алкен несимметричный, атом бора присоединяется преимущественно к наименее замещенному атому углерода:
Такое направление присоединения вызвано в первую очередь пространственными эффектами. Электронные эффекты в алкене также играют определенную роль, хотя и в меньшей степени. Таким образом, реакция гидроборирования является региоселективной. Региоселективность присоединения боранов определяется структурой алкена:
Если в алкене, к которому присоединяется диборан, имеются значительные пространственные затруднения, то триалкилборан не образуется. Реакция останавливается на стадии образования диалкил- или моноалкилборана.
В соответствии с электроотрицательностями бора и углерода поляризация связи углерод-бор в алкилборанах такова: δ δ
Под действием кислот происходит расщепление связи С-В, при этом протон атакует атом углерода, несущий частичный отрицательный заряд.
В этой реакции наиболее эффективна уксусная кислота, поскольку атом бора весьма склонен образовывать связи с кислородом. Галогеноводородные кислоты менее эффективны. По-видимому, в случае уксусной кислоты расщеплению связи С-В предшествует координация атома кислорода карбоксильной группы с атомом бора.
Таким образом, последовательность реакций гидроборирования и расщепления триалкилборана кислотой является непрямым методом гидрирования алкенов.
С помощью реакции гидроборирования из алкенов можно синтезировать различные алкины. Для этого используется способность триалкилборана выступать в качестве кислоты Льюиса и давать комплексные анионы. Алкины с внутренним положением тройной углерод-углеродной связи получают из литиевых солей терминальных алкинов.
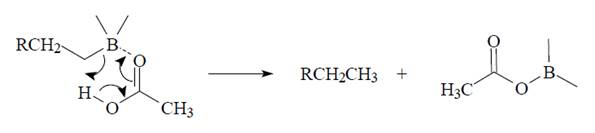
При планировании синтезов с использованием диборана следует иметь в виду, что диборан восстанавливает многие функциональные группы. Относительная легкость восстановления функциональных групп дибораном приведена ниже: O
В присутствии избытка BF3 диборан восстанавливает сложные эфиры в простые:
Введение алкильных заместителей увеличивает долю 1,4-диола (87% в случае изопрена, 100% - для 2,3-диметилбутадиена). Однако в случае циклических диенов образуется смесь диолов.
С ацетиленом диборан реагирует при 100 °С со взрывом. В контролируемых условиях при более низкой температуре алкины с внутренним положением тройной связи с умеренными выходами дают алкенилбораны.
Гидроалюминирование
Помимо реакции гидроборирования, в синтезе находят применение также реакции присоединения по кратным связям гидридов алюминия. Наиболее популярным реагентом в этом отношении является диизобутилалюмогидрид (i-C4H9)2AlH (ДИБАЛ-Н). В промышленности его получают в две стадии из 2-метилпропена, порошка алюминия и газообразного водорода.
ДИБАЛ-Н
Реагент поступает в продажу либо в индивидуальном состоянии, либо в виде 1М раствора в толуоле. В индивидуальном состоянии вещество пирофорно. Работать с ним следует в атмосфере инертного газа (азота или аргона). В качестве растворителей для проведения реакций с ДИБАЛ-H пригодны эфир, бензол, толуол, циклогексан. Тетрагидрофуран образует с этим реагентом комплекс. Отличительным свойством ДИБАЛ-Н является легко протекающее присоединение этого реагента по тройной углерод-углеродной связи даже при низких температурах. Двойные связи С=С подвергаются гидроалюминированию гораздо медленнее. Это позволяет превращать алкины, особенно терминальные, в алкены.
Как видно из приведенной выше схемы, дальнейшие превращения полученного алкенильного производного алюминия зависят от используемого реагента. Присоединение ДИБАЛ-Н к внутренней тройной углерод-углеродной связи происходит в более жестких условиях.
Как и в случае гидроборирования, гидроалюминирование является региоселективным процессом, то есть атом алюминия предпочтительно связывается с менее замещенным атомом углерода:
ДИБАЛ-Н также присоединяется по концевой С=С связи, хотя и медленнее, чем к алкинам. Алкены с внутренним расположением связи С=С реагируют очень медленно даже при температуре 70-80°С. Это делает возможным селективное гидрирование терминальной С=С связи диенов и триенов.
При использовании ДИБАЛ-Н в синтезе следует помнить, что этот реагент достаточно легко восстанавливает многие функциональные группы (COOR, CN и др). Большое значение имеет гидроалюминирование пропаргиловых спиртов. Эта реакция происходит при действии алюмогидрида лития и приводит к спиртам аллилового типа, алкеновый фрагмент которых имеет E-конфигурацию.
На основе этой реакции можно получать винилгалогениды с определенной стереохимической конфигурацией, например:
|



























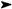






 Таким образом, на скорость гидрирования большое влияние оказывает экранированность двойной связи. По этой причине удается провести селективное гидрирование одной из двух C=C связей, имеющих разную степень замещения.
Таким образом, на скорость гидрирования большое влияние оказывает экранированность двойной связи. По этой причине удается провести селективное гидрирование одной из двух C=C связей, имеющих разную степень замещения.












 (R-CH2-CH2)3B
(R-CH2-CH2)3B



 -COOH > >RR1C=O > RCN > >> -COOR
-COOH > >RR1C=O > RCN > >> -COOR
 Не восстанавливаются дибораном следующие типы соединений: RC(O)Cl, RNO2, RSO2R1, RHal, ArHal, ROR1, ArOH. Диборан и алкилгидриды бора также реагируют с диенами и алкинами. В случае несопряженных диенов направление гидроборирования аналогично направлению реакции с алкенами. Сопряженные диены вступают в две последовательные реакции 1,2-присоединения, образуя смесь 1,3- и 1,4-диборанов, относительные количества которых зависят от строения диена и гидроборирующего агента, а также от способа прибавления реагентов. Обычно преобладает 1,4-аддукт. Например, обработка щелочным раствором перекиси водорода реакционной смеси, полученной при обработке дибораном 1,3-бутадиена, дает 65-76% 1,4-бутандиола и 24-35% 1,3-бутандиола.
Не восстанавливаются дибораном следующие типы соединений: RC(O)Cl, RNO2, RSO2R1, RHal, ArHal, ROR1, ArOH. Диборан и алкилгидриды бора также реагируют с диенами и алкинами. В случае несопряженных диенов направление гидроборирования аналогично направлению реакции с алкенами. Сопряженные диены вступают в две последовательные реакции 1,2-присоединения, образуя смесь 1,3- и 1,4-диборанов, относительные количества которых зависят от строения диена и гидроборирующего агента, а также от способа прибавления реагентов. Обычно преобладает 1,4-аддукт. Например, обработка щелочным раствором перекиси водорода реакционной смеси, полученной при обработке дибораном 1,3-бутадиена, дает 65-76% 1,4-бутандиола и 24-35% 1,3-бутандиола.











 Обработка алкенилборанов щелочным раствором пероксида водорода приводит к образованию альдегидов или кетонов.
Обработка алкенилборанов щелочным раствором пероксида водорода приводит к образованию альдегидов или кетонов.






