 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| СТРОЕНИЕ, СТЕРЕОИЗОМЕРИЯ И НОМЕНКЛАТУРА МОНОСАХАРИДОВ 12
Классификация углеводов — Моносахариды(простые сахара, например, глюкоза) — Олигосахариды(углеводы, содержащие 2-10 остатков моносахаридов, например сахароза). — Полисахариды (углеводы, содержащие более 10 остатков моносахаридов, но обычно – тысячи и миллионы).
СТРОЕНИЕ, СТЕРЕОИЗОМЕРИЯ И НОМЕНКЛАТУРА МОНОСАХАРИДОВ
Углеводы, соединения общей формулы Сn(H2O)n, от которой и получили свое название, представляют собой многоатомные альдегидоспирты или кетоспирты.
Углеводы являются энантиомерами. Энантиомеры — пара стереоизомеров, зеркальные отражения молекул, не совмещаемые в пространстве. Энантиомеры имеют одинаковые химические и физические свойства, кроме способности вращать плоскость поляризации плоскополяризованного света на одинаковую величину угла, но в противоположных направлениях (оптическая активность). Свойством энантиомерии обладают соединения, содержащие хиральный атом. Ассимерический центр (центр хиральности, оптический центр) – это атом С, связанный с четырьмя различными заместителями. 1.Энантиомер именуется по направлению, в котором его раствор вращает плоскость поляризации света,что можно наблюдать при помощи поляриметра. Если вращение происходит по часовой стрелке, то такой энантиомер называется (+), или правовращающим. Его оптический антипод именуется (–), или левовращающим. При прохождении света через раствор одного из энантиомеров происходит отклонение плоскости поляризации влево, другого - вправо на один тот же по величине угол α. Мерой оптической активности является [aD] -удельный угол вращения.
. Цепь атомов углеродного остова изображается как прямая вертикальная линия, сверху которой обозначена старшая функциональная группа. При горизонтальных линиях изображены конформации у асимметрических углеродных центров (сами атомы углерода не показаны, они располагаются "в перекрестии"). В общем случае молекула с "n" хиральными центрами имеет 2n стереоизомеров.
Гомохиральность-природные хиральные аминокислоты и моносахариды представлены в виде единственного изомера из двух возможных. В состав белков входят практически исключительно l-аминокислоты, а ДНК и РНК построены только на основе d-углеводов. Две энантиомерные формы одной молекулы обычно имеют различную биологическую активность. Это связано с тем, что рецепторы, ферменты, антитела и другие элементы организма также обладают хиральностью, и структурное несоответствие между этими элементами и хиральными молекулами препятствует их взаимодействию. 3.R/S-номенклатура энантиомеров позволяет охарактеризовать энантиомер по его абсолютной конфигурации,установленной ренгентоструктурным анализом.Хиральному атому углерода присваивается обозначение R или S на основании взаимного расположения четырёх связанных с ним заместителей. Молекулу ориентируют так, чтобы младший заместитель был направлен в сторону от наблюдателя, и устанавливают направление падения старшинства остальных трёх заместителей. Если старшинство уменьшается по часовой стрелке, то конфигурацию атома углерода обозначают R (лат. rectus — правый). В противоположном случае конфигурацию обозначают S (лат. sinister — левый). R/S-номенклатура не имеет непосредственной связи с (+/–)-обозначениями. Например, R-изомер может быть как правовращающим, так и левовращающим, в зависимости от конкретных заместителей при хиральном атоме. Диастереомеры — стереоизомеры, не являющиеся зеркальными отражениями друг друга. Диастереомерия возникает, когда соединение имеет несколько стереоцентров. Если два стереоизомера имеют противоположные конфигурации всех соответствующих стереоцентров, то они являются энантиомерами. Однако, если конфигурация различается лишь у некоторых стереоцентров, то такие стереизомеры являются диастереомерами. Если диастереомеры отличаются конфигурацией лишь одного стереоцентра, то они называются эпимерами.
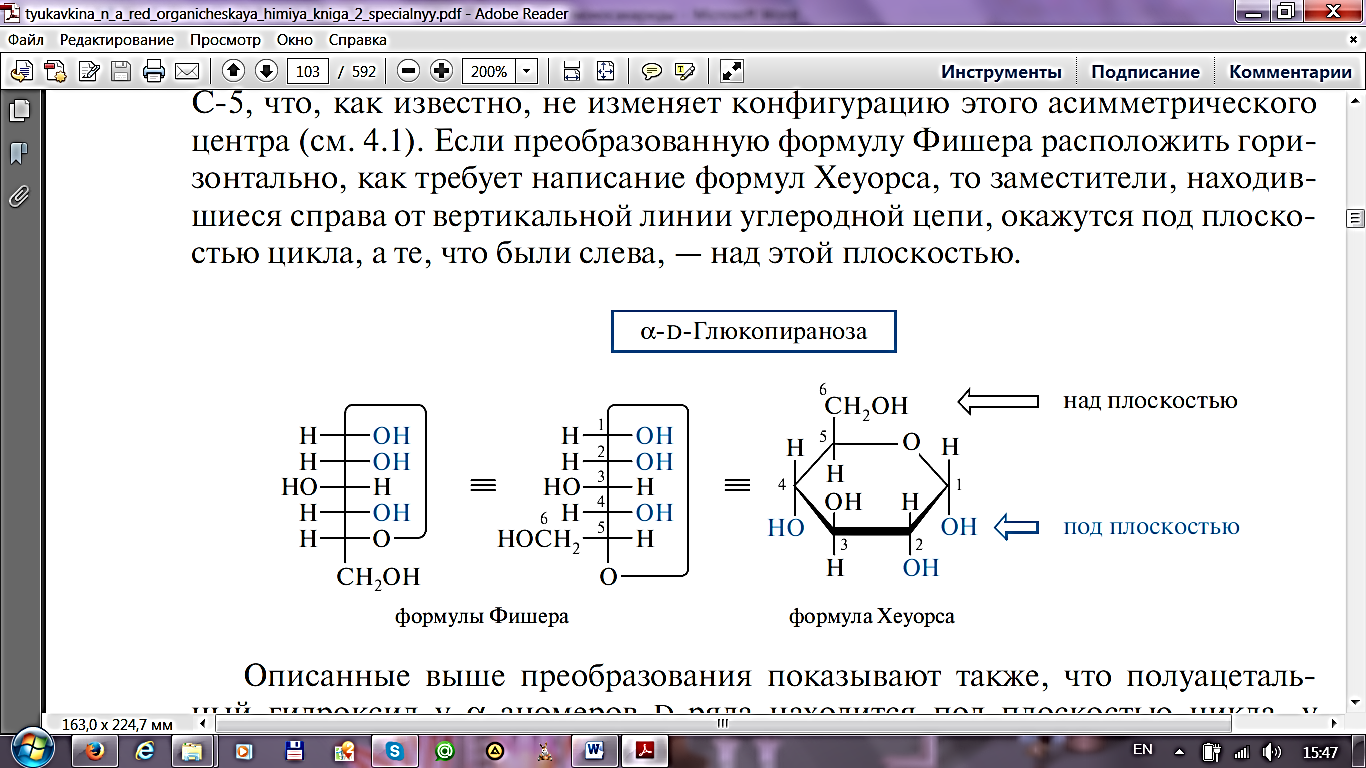
Основной формой существования углеводов в твердом виде и растворах является циклическая форма.Циклическая форма углеводов появляется в результате внутримолекулярной реакции образования полуацеталя, когда карбонильная группа взаимодействует с одним из гидроксилов той же молекулы.
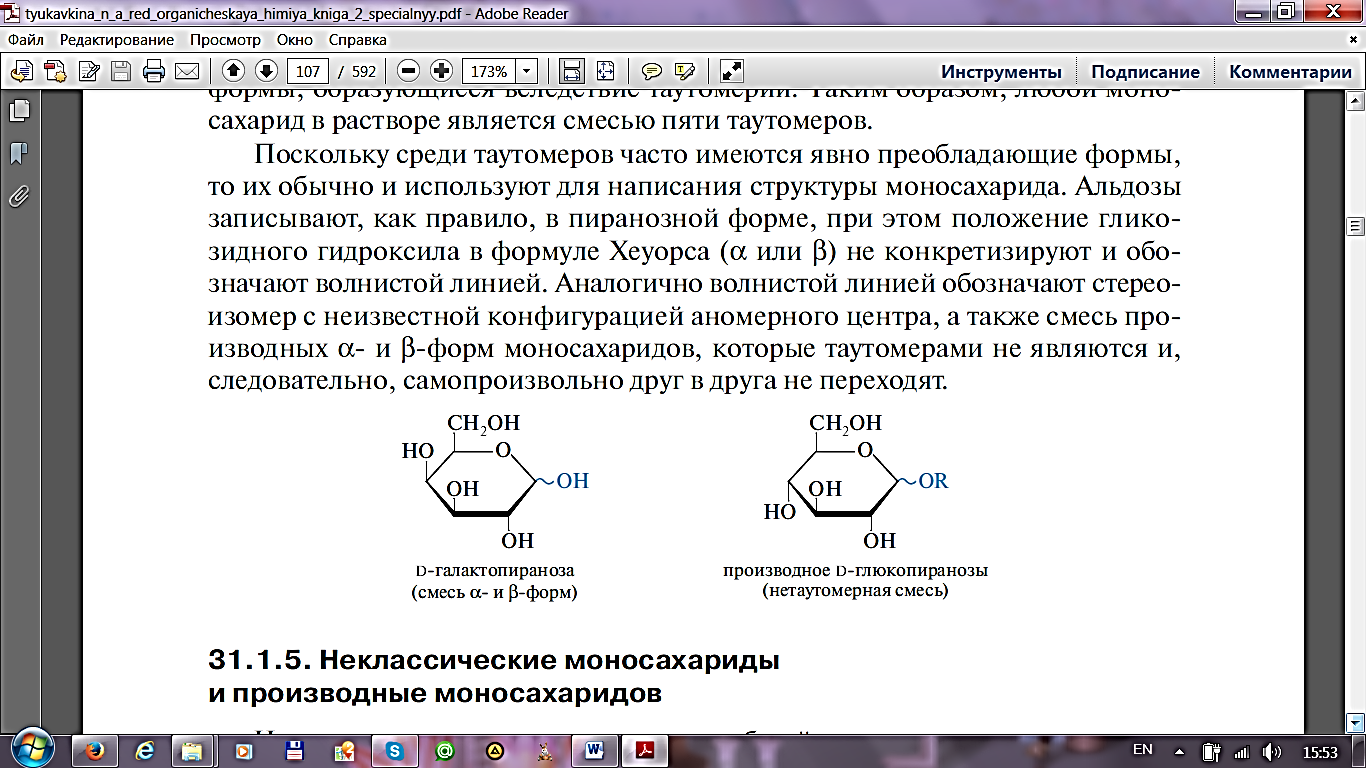
В результате циклообразования возникает дополнительный центр асимметрии, при углероде под номером 1. Конформация при этом атоме углерода теперь определяет один из двух новых изомеров, которые называют аномерами (α- и β- аномеры). Гидроксильная группа при новом центре асимметрии является полуацетальной, что резко отличает ее по химическим свойствам от остальных гидроксилов в молекуле. Поэтому ее называют аномерным (или гликозидным) гидроксилом.
Мутаротация, или аномеризация - взаимопревращение аномерных форм моносахаридов.
Таким образом выглядят таутомерные формы фруктозы.
ПРОИЗВОДНЫЕ МОНОСАХАРИДОВ. В номенклатуре IUPAC названия индивидуальных урононовых кислот образуются заменой суффикса -оза в названии соответствующей альдозы на суффикс -уроновая кислота, например — «глюкоза В номенклатуре IUPAC названия индивидуальных альдоновых кислот образуются заменой суффикса -оза в названии соответствующей альдозы на суффикс -оновая кислота, например — «глюкоза В номенклатуре IUPAC названия индивидуальных альдаровых кислот образуются заменой суффикса -оза в названии соответствующей альдозы на суффикс -аровая кислота. Например — «глюкоза Окисление глюкозы. При воздействии различными окислителями могут быть получены различные сахарные кислоты (гликаровые, гликоновые или гликуроновые):
!!!!!!! Реактив Фелинга-тартратный комплекс Cu2+,реактив Бенедикта-цитратный комплекс Cu2+,реактив Толленса-аммиачный раствор оксида серебра Биологическое значение уроновых кислот: 1.входят в состав многих природных полисахаридов — гепарина, гиалуроновой кислоты. 2.Через промежуточное образование уроновых кислот идет побочный окислительный путь метаболизма глюкозо-6-фосфата, в результате чего из глюкозы образуются аскорбиновая кислота и пентозы. Промежуточным метаболитом этого пути является уридиндифосфатглюкуроновая кислота (УДФ-глюконурат-активная форма глюкуроновой кислоты)
которая в гепатоцитах образует под действием даёт конъюгаты — глюкурониды с катаболитами (желчные пигменты, такие как билирубин, стероиды) и ксенобиотиками(амины, тиолы, фенолы, карбоновые кислоты). 12 |






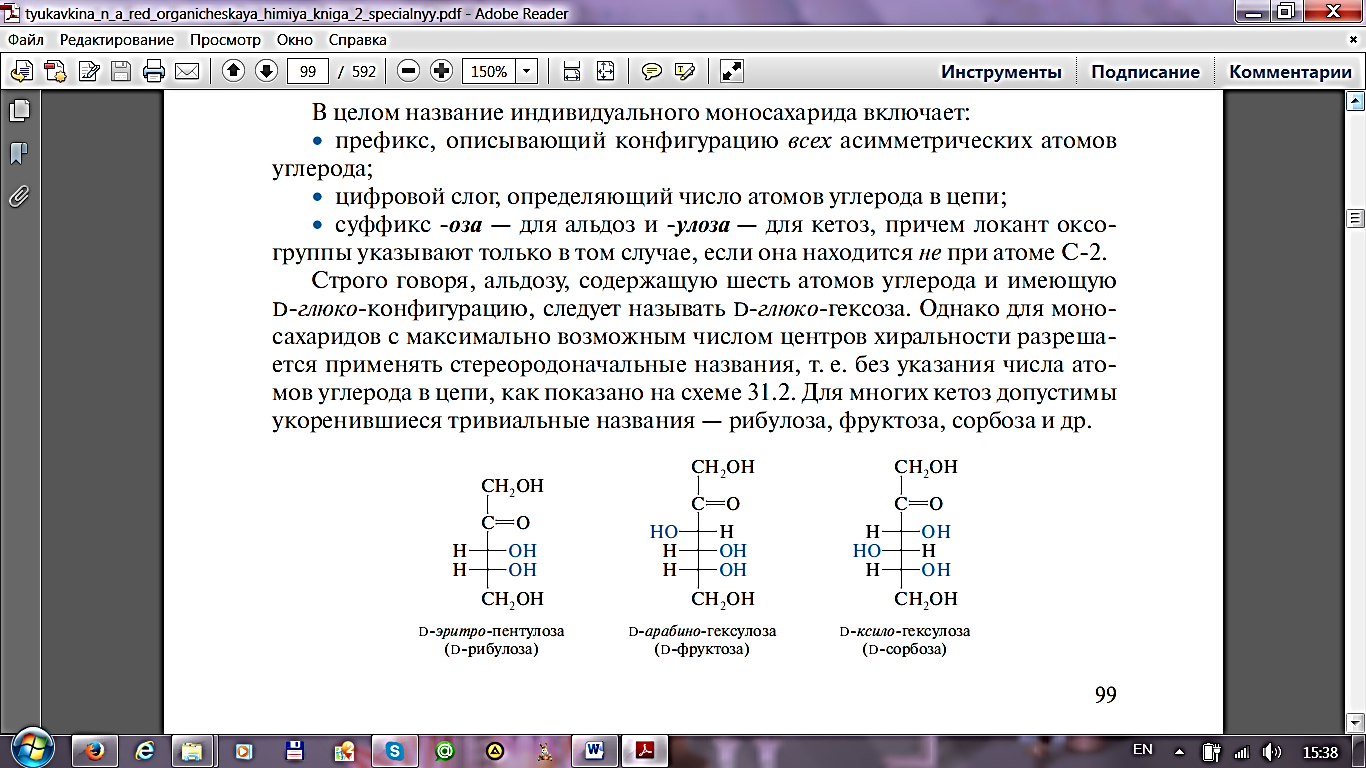
 2.d/l-номенклатура энантиомеров была введена Э. Фишером для описания относительной конфигурации моносахаридов. Она основана на конфигурации глицеринового альдегида, существующего в виде двух энантиомеров, из которых путём последовательных реакций наращивания углеродной цепи можно получить производные моносахариды (тетрозы, пентозы, гексозы и т. д.).
2.d/l-номенклатура энантиомеров была введена Э. Фишером для описания относительной конфигурации моносахаридов. Она основана на конфигурации глицеринового альдегида, существующего в виде двух энантиомеров, из которых путём последовательных реакций наращивания углеродной цепи можно получить производные моносахариды (тетрозы, пентозы, гексозы и т. д.).










 Конформации моносахаридов определяют пространственную вторичную структуру полисахаридов.
Конформации моносахаридов определяют пространственную вторичную структуру полисахаридов.


 глюкуроновая кислота». Названия анионов этих кислот образуются заменой суффикса -оза в названии альдозы на суффикс -уронат, например — «глюкоза
глюкуроновая кислота». Названия анионов этих кислот образуются заменой суффикса -оза в названии альдозы на суффикс -уронат, например — «глюкоза 

 ,
,