 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Массовая концентрация (кг/м3, г/м3).
Общие сведения Бутанол С4Н9ОН
Физико-химические свойства Бесцветная вязковатая жидкость с характерным запахом сивушного масла, плотность 0,81 г/см3, температура плавления -90,2 °С, температура кипения 117,4 °С, растворимость в воде 7,9 г/100 мл, диэлектрическая проницаемость 17,7, предельно допустимая концентрация паров в воздухе рабочей зоны 10 мг/м. Расчет относительной плотности паров по воздуху (Dвозд). Относительная плотность газа (пара) по воздуху определяется по формуле:
Молекулярная масса бутанола С4Н9ОН равна 74.
2.2. Расчет плотности паров при нормальных условиях (ρпар = М/Vм, кг/м3).
Молярная масса бутанола составляет 74 г/моль. Значит плотность бутанола при нормальных условиях составит:
Расчет процентного элементного состава вещества. Молярная масса бутанола составляет 74 г/моль. Процентное содержание углерода составит [С] = 48/74 = 64,9 % Процентное содержание водорода составит [Н] = 10/74 = 13,5 % Процентное содержание кислорода составит [О] = 16/74 = 21,6 % Расчет коэффициента горючести. Коэффициент горючести рассчитывается по следующей формуле:
водорода, азота, кислорода, хлора, фтора и брома в молекуле вещества.
В молекуле бутанола n (С) = 4, n (Н) = 10, n (О) = 1 К = 4*4 + 10 – 1 = 25 Так как коэффициент горючести бутанола больше единицы (К ≥ 1), бутанол является горючим веществом.
Расчет характеристик горения Определение характера свечения пламени. Характер свечения пламени при горении веществ зависит от процентного содержания элементов в веществе, главным образом, углерода, водорода, кислорода и азота. Массовые доли углерода и кислорода в молекуле бутанола составляют [С] = 48/74 = 64,9 %, [О] = 16/74 = 21,6 %. Так как массовая доля углерода > 50 %, а массовая доля кислорода < 25 %, следовательно, пламя при горении бутанола яркое и коптящее.
Низшая теплота сгорания. Низшая теплота сгорания вещества может быть рассчитана по формуле Д.И.Менделеева
Уравнение реакции горения. Составим уравнение реакции горения бутанола в воздухе: С4Н9ОН + 6(O2 + 3,76N2) = 4CO2 + 5H2O + 6×3,76N2 Объем воздуха на горение (теоретический). (для 1 кг горючего вещества при нормальных условиях) Теоретический объем воздуха, необходимый для горения рассчитывается по уравнению реакции горения. 1 кг С4Н9ОН + 6(O2 + 3,76N2) = 4CO2 + 5H2O + 6×3,76N2 М=74 кг 6*4,76*22,4 м3 По уравнению реакции найдем теоретический объем воздуха, необходимый для полного сгорания бутанола:
Объем и состав продуктов горения (теоретический) (для 1 кг горючего вещества при нормальных условиях) 1 кг х1 х2 х3 х4 С4Н9ОН + 6(O2 + 3,76N2) = 4CO2 + 5H2O + 6×3,76N2 М=74 кг 6*4,76*22,4 м3 4*22,4 м3 5*22,4 м3 6*3,76*22,4 м3 1) Теоретический объем продуктов горения определяем по уравнению реакции.
2) Определим объем отдельных компонентов продуктов горения бутанола: V (CO2) = х2 = (1*4*22,4)/74 = 1,2 м3 V (H2O) = х3 = (1*5*22,4)/74 = 1,5 м3 V (N2) = х4 = (1*6*3,76*22,4)/74 = 6,9 м3 3) Определим объемную концентрацию каждого компонента по формулам:
Стехиометрическая концентрация в паровоздушной смеси. 3.6.1. Объемная концентрация (%). С4Н9ОН + 6(O2 + 3,76N2) = 4CO2 + 5H2O + 6×3,76N2
Рассчитаем стехиометрическую концентрацию по уравнению реакции горения индивидуального вещества по формуле:
Массовая концентрация (кг/м3, г/м3). Рассчитаем стехиометрическую концентрацию по уравнению реакции горения индивидуального вещества по формуле:
3.7. Концентрационные пределы распространения пламени. Рассчитаем концентрационные пределы распространения пламени (область воспламенения) бутанола по следующей формуле:
где пламени ( НКПР и ВКПР ), %; β - число молекул кислорода ( коэффициент перед кислородом в уравнении реакции горения вещества ); a и b - константы С4Н9ОН + 6(O2 + 3,76N2) = 4CO2 + 5H2O + 6×3,76N2
3.8. Расчет давления насыщенного пара по уравнению Антуана (для температуры 25°С). Рассчитаем давление насыщенного пара бутанола при заданной температуре по уравнению Антуана:
где Р - давление насыщенного пара, кПа; tР - рабочая (заданная) температура, °С; А, В, С - константы уравнения Антуана (приводятся в справочной литературе). Запишем уравнение Антуана для бутанола:
Таким образом, константы уравнения Антуана: А = 8,72232, В = 2664,684, С = 279,638, t = 25°С Р = 10 (8,72232-2664,684/279,638+25) = 10 -0,024 = 0,946 кПа
Список использованной литературы 1. Е.Г. Коробейникова. Химия процессов горения: Методические рекомендации по выполнению контрольной работы и контрольные задания по специальности 280705.65 – "Пожарная безопасность". СПб.: Санкт-Петербургский университет ГПС МЧС России, 2011. 2. Корольченко А.Я. Процессы горения и взрыва. М.: Пожнаука, 2007. 3. Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И. Ермакова. – изд. 30-е, исправленное-М.: Интеграл-Пресс, 2007. 4. А.С. Андросов, И.Р. Бегишев. Лабораторный практикум по курсу «Теория горения и взрыва». М., 2006.
|



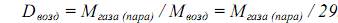
 = 74/29 = 2,55
= 74/29 = 2,55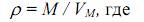

 = 74/22,4 = 3,3 л/моль
= 74/22,4 = 3,3 л/моль
 -число атомов углерода, серы,
-число атомов углерода, серы,
 = 33,4*64,9 + 1257*13,5 – 108,9*21,6 – 25,1*9*13,5 = 33594 кДж/кг = 33,6 МДж/кг.
= 33,4*64,9 + 1257*13,5 – 108,9*21,6 – 25,1*9*13,5 = 33594 кДж/кг = 33,6 МДж/кг. = 1*6*4,76*22,4/74 = 8,7 м3
= 1*6*4,76*22,4/74 = 8,7 м3 = (1*(4+5+6*3,76)*22,4)/74 = 9,6 м3
= (1*(4+5+6*3,76)*22,4)/74 = 9,6 м3


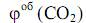 = (1,2*100)/9,6 = 12,5%
= (1,2*100)/9,6 = 12,5%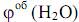 = (1,5*100)/9,6 = 15,6%
= (1,5*100)/9,6 = 15,6% = (6,9*100)/9,6 = 71,8%
= (6,9*100)/9,6 = 71,8% = 6
= 6
 = 100/(1+4,76*6) = 3,38%
= 100/(1+4,76*6) = 3,38%
 = 100/((1+4,76*6)*22,4) = 111,7 г/м3
= 100/((1+4,76*6)*22,4) = 111,7 г/м3
 - нижний (верхний) концентрационный предел распространения
- нижний (верхний) концентрационный предел распространения = 100/(8,684*6+4,679 = 1,76%
= 100/(8,684*6+4,679 = 1,76% = 100/(1,55*6+0,56) = 10,14%
= 100/(1,55*6+0,56) = 10,14%
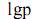 = 8,72232 - 2664,684/(279,638 + t)
= 8,72232 - 2664,684/(279,638 + t)