 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Термодинамическая фазовая рТ-диаграмма. 12
Изменение энтропии. Т.к. Ср>Сv , то изменение энтропии при изобарном процессе будет больше чем при изохорном. Изобара 1-2 при одинаковой температуре Т1 и Т2 более пологая чем изохора 1,2’.
3. Изотермический пр-с изм сост ид газа. Т=const. dT=0
Изменение энтропии:
Адиабатный пр-с изм сост ид газа. Адиабатным процессом наз пр-с происходящий без теплообмена с окруж средой.
Первое Т/Д: Адиабата идет круче чем изотерма.
В адиаб пр-се работа совершается за счет убыли внутр энергии рабочего тела.
Располагаемая работа l0 для адиаб пр-са в К раз больше удельной работы расширения газа и противоположна ей по знаку. Из ур-я адиабаты видно, т.к. K>1, то адиабата идет круче чем изотерма. Т.к. адиабата идет круче чем изотерма то адиаб пр-с идет без теплообмена с окр средой и расширение газа происходит только за счет падения ее внутр энергии, в изотерм пр-се расширение газа происходит за счет подведения теплоты. Если от т А сжать газ, то адиабата А1 располагается круче изотермы А1’, т.к. при адиабатном пр-се теплота не отводится и температура газа с увеличением давления растет больше чем в изотермическом пр-се.
5. Политропный пр-с – прс-с в котором удельная теплоемкость остается постоянной. График процесса политропы – это кривая которая описывает газовые пр-сы, в кот-ых происходит изменение всех термодинамических параметров. Кол-во подведенной теплоты: Соотношение параметров. Заменим показатель адиабаты на показатель политропы. Получим, Теплоемкость:
Пр-сы начинающиеся в т А и проходящие с расширением рабочего тела имеют положительную работу. Пр-сы в области 5,6,7,8 имеют отрицат работу, т к рабочее тело в этих областях сжимается. Для 1,2,3,8 проходят при подводе теплоты, а в области 4,5,6,7 – с отводом теплоты. Пр-сы происходящие во 2ой, 7,8 сопровожд повышением температуры раб тела. 3,5,6,4 – температура понижается. 3 – при подводе теплоты происходит падение температуры раб тела, 7 – происходит повыш темпер, при отводе теплоты к раб телу. Вывод изменения энтропии:
Термодинамическая фазовая рТ-диаграмма. Все прямые фазовые переходы требуют подвода теплоты и происходят при постоянном давлении и постоянной температуре. Переход из одного агрегатного состояния в другое принято рассматривать на РТ-диаграмме. Если взять в кач-ве независимого параметра Т, то есть три линии: p=f1(T)-AK – соответ. равновесному состоянию Ж и Г фазы- испарение p=f2(T)-AC p=f3(T)-AB. Эти линии представляют геометрич место точек в которых находится в равновесном состоянии любая пара из 3х агрегатных состояний. АС-соответствует равновесному состоянию Т и Г фазы (сублимация по прямому пр-су)- десублимация. АВ-соответ равновесному состоянию Т и Ж фазы – плавление (кристаллизация) Температура при котором происходит переход из Твердого состояния в Ж – Тпл, Ткрист. Кол-во теплоты подведенное в этом пр-се – теплота плавления (кристаллиз). Температура перехода в-ва из Ж в Г – Ткип, (Тконд). Теплота в этом пр-се которое выделяется или поглощается – теплота парообразования или теплота конденсации. Температура из Т в Пар – температура сублимации. Теплота подведенная или отведенная назыв теплотой сублимации. Кривая на которых происходит в зависимости от давления и температуры переход из Ж состояния в Г заканчивается в точке К – это критическая точка. В т К исчезает физическое различие между жидким и газообразным состоянием в-ва, а точнее плотности пара водяной смеси равной плотности жидкости. Критическое давление – Рк = 22,12 МПа, Тк = 374,16 С. Все три кривые пересекаются в т А которая наз тройной точкой. В этой точке исчезает различие между тремя фазами Т Ж Г. Изобарная теплоемкость для фазового перехода равна бесконечности. Коэффициент изобарного (объемного) расширения: Коэффициент изотермического сжатия:
Уравнение Клайперона-Клазиуса связывает температуру, давление, удельный объем с теплотой фазового перехода
12 |



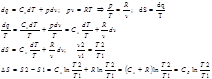


 В изотермическом пр-се идеальная работа газа, располагаемая работа, изменение объема и удельное количество теплоты равны между собой.
В изотермическом пр-се идеальная работа газа, располагаемая работа, изменение объема и удельное количество теплоты равны между собой.






 Если n=
Если n= 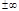 то v=сonst; n=0 – p=const; n=1 – T=const; n=k – уравнение адиаб пр-са S=const. Политропный пр-с обобщает все раннее рассмотренные пр-сы.
то v=сonst; n=0 – p=const; n=1 – T=const; n=k – уравнение адиаб пр-са S=const. Политропный пр-с обобщает все раннее рассмотренные пр-сы. Работа в политропном пр-се. Для работы в политропном пр-се используется выражение работы в адиаб пр-се заменим K на n.
Работа в политропном пр-се. Для работы в политропном пр-се используется выражение работы в адиаб пр-се заменим K на n.  Располагаемая работа l0 в n раз больше удельной работы:
Располагаемая работа l0 в n раз больше удельной работы: 







 , где
, где  - произведение от давления по температуре взятое на кривой фазового перехода,
- произведение от давления по температуре взятое на кривой фазового перехода,  - теплота фазового перехода, dT – температура фазового перехода, v′′- удельный объем пара, v′- удельный объем жидкости или твердого тела. В общем виде ур-е характеризуется изменением давления фаз находящихся в равновесии от Т. Для плавления (линия АВ):
- теплота фазового перехода, dT – температура фазового перехода, v′′- удельный объем пара, v′- удельный объем жидкости или твердого тела. В общем виде ур-е характеризуется изменением давления фаз находящихся в равновесии от Т. Для плавления (линия АВ):  - удельная теплота плавления, v′-удельный объем тв тела; Для парообразования (АК): q –удельная теплота парообразования, Т – удельная температура парообразования, v′-удельный объем жидкости; При сублимации (АС) – q –удельная теплота сублимации, Т – температура сублимации, v′- удельный объем тв тела. С помощью этого ур-я можно установить наклон линии плавления, парообразования, сублимации в тройной точке
- удельная теплота плавления, v′-удельный объем тв тела; Для парообразования (АК): q –удельная теплота парообразования, Т – удельная температура парообразования, v′-удельный объем жидкости; При сублимации (АС) – q –удельная теплота сублимации, Т – температура сублимации, v′- удельный объем тв тела. С помощью этого ур-я можно установить наклон линии плавления, парообразования, сублимации в тройной точке  - для всех в-в кроме воды. Проведенные касательные к А для 3-х линий: АК, АВ, АС. α1, α2, α3 – углы наклона касательной кривой. АВ, АК и АС в т.А к оси Т <90˚ . v′′- v′ <0 для всех в-в. Для воды
- для всех в-в кроме воды. Проведенные касательные к А для 3-х линий: АК, АВ, АС. α1, α2, α3 – углы наклона касательной кривой. АВ, АК и АС в т.А к оси Т <90˚ . v′′- v′ <0 для всех в-в. Для воды 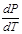 < 0 и поэтому α4>90˚. Для всех нормальных жидкостей для которых разница > 0 все линии фазового перехода отклонены вправо. А для воды с повышенным давлением линия отклонена не вправо, а влево.
< 0 и поэтому α4>90˚. Для всех нормальных жидкостей для которых разница > 0 все линии фазового перехода отклонены вправо. А для воды с повышенным давлением линия отклонена не вправо, а влево.