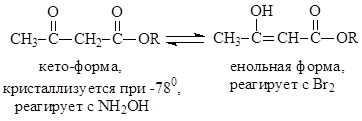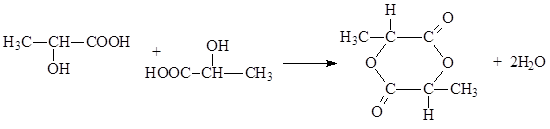ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Предельные одноосновные кислоты.
Лекция №10 Карбоновые кислоты
Молекула карбоновых кислот содержит карбоксильную группу
(карбоксилом). Карбоксил в соединении может быть связан с алкильной группой (предельные карбоновые кислоты) или остатком алкена (непредельные карбоновые кислоты). Кроме того, карбоновая кислота может содержать несколько карбоксилов. От их числа зависит основность кислоты.
Предельные одноосновные кислоты. В тривиальных названиях кислот отражен их природный источник. Например, три кислоты, С6,8,10 углеродных атомов, были выделены из продуктов гидролиза сливочного масла из козьего жира и названы соответственно капроновой, каприловой и каприновой кислотами (от латинского caper – коза). Кислоты и их названия по тривиальной и систематической номенклатурам
По систематической номенклатуре карбоновая кислота свое название получает от названия соответствующего углеводорода с наиболее длинной цепью углеродных атомов. Цепь нумеруется, причем отсчет начинается от карбоксильного углерода. В названии указываются радикалы-заместители, и их положение. Следует отметить, что некоторые кислоты с большим количеством углеродов в молекуле, относят в высшим жирным кислотам (например, пальмитиновая и стеариновая). Этим названием объединяются встречающиеся в природе кислоты с неразветвленной цепью, которые в виде эфиров входят в состав жиров, восков и масел растений и животных. При отнятии гидроксильной группы от карбоксила получаются одновалентные кислотные остатки или ацилы,а при отщеплении водорода – так называемые ацилатные группы Н-СО- формил Н-СОО- формиат СН3СО- ацетил СН3СОО- ацетат СН3СН2СО- пропионил СН3СН2СОО- пропионат СН3СН2СН2СО- бутирил СН3СН2СН2СОО- бутират СН3СН2СН2СН2СО- валерил СН3СН2СН2СН2СОО- валерат
Названия производных карбоновых кислот связаны с названиями самих кислот. Как составляются названия производных кислот, видно из приводимых ниже примеров
СН3СООН СН3СООNa СН3СОCl уксусная кислота ацетат натрия ацетилхлорид этановая кислота этаноат натрия этаноилхлорид
(СН3СО)2О СН3СН2ОСОСН3 СН3СОNН2 уксусный ангидрид этилацетат ацетамид этановый ангидрид этилэтаноат этанамид
СН3СОNНСН3 СН3СN N-метилацетамид ацетонитрил N- метилэтанамид этаннитрил
1.2. Методы получения.
Это реакции окисленияалканов, алкенов и алкинов, первичных спиртов и альдегидов, гидролиз галогенпроизводных с тремя галогенами у одного углерода и производных карбоновых кислот: нитрилов, сложных эфиров, ортоэфиров, ангидридов, галогенангидридов и амидов. и др. 1.2. Физические свойства.
Одно из удивительных свойств карбоновых кислот – это их высокая температура кипения. Для сравнения ниже приведены температуры кипения некоторых соединений (0С) уксусный альдегид 21 этилацетат 77 этанол 79 уксусная кислота 118 У кислот температуры кипения еще выше, чем у спиртов. Это уже трудно объяснить только возникновением водородных связей между молекулами кислоты. Молекулы карбоновых кислот могут связаться друг с другом не одной, а двумя водородными связями
В результате две молекулы кислоты оказываются связанными настолько прочно, что они существуют в виде димера не только в жидкой или твердой фазе, но даже в парах. Высокая растворимость низших кислот в воде также объясняется образованием водородных связей с участием молекул кислоты и растворителя. При этом молекулы воды вклиниваются между молекулами карбоновой кислоты
Химические свойства.
Химические свойства карбоновых кислот обусловлены наличием в их молекуле карбоксильной группы, представляющей собой сочетание карбонильной и гидроксильной групп. Вместе с тем, химические свойства карбоновых кислот не просто сочетание свойств, присущих спиртам и карбонильным соединениям, это и новое качество. 1.3.1. Кислотность. Образование солей.
Одноосновные предельные карбоновые кислоты являются хотя и слабыми, но «настоящими» кислотами – их можно обнаружить с помощью лакмусовой бумаги. Являясь кислотами, карбоновые кислоты служат источником протонов, следовательно, они способны к ионизации. В водном растворе кислота ионизирует по уравнению
Между кислотой и карбоксилат-анионом и протоном устанавливается равновесие. Константа равновесия Ка (константа кислотности, acid – кислота) связывающая концентрации, вычисляется на основе уравнения
я в кислотности? Ионизация этанола и уксусной кислоты протекает с образованием соответственно алкоголят– и карбоксилат– аниона
Самым сильным среди карбоновых кислот является муравьиная кислота. Появление при карбоксильной группе метильного электронодонорного радикала вместо водорода приводит к ослаблению кислотности почти в десять раз. В случае замещения водородных атомов в метильной группе на галогены возникает электроноакцепторный заместитель, который усиливает кислотность. Порядок изменения кислотности (105Ка) ряда кислот подтверждает сказанное
НСООН 17,7 СН3СООН 1,75 ClСН2СООН 136 Cl2CHCOOH 5530 Cl3ССООН 23200 СН3СН2СН2СООН 1,52 СН3СН2СНClСООН 139 СН3СНClСН2СООН 8,9 СН2ClСН2СН2СООН 2,96
Итак, карбоновые кислоты относятся к слабым кислотам и в реакции со щелочами дают соли
При пиролизе солей щелочных металлов с участием едкой щелочи происходит декарбоксилирование и образование алканов. Пиролиз кальциевых или бариевых солей в отсутствии щелочи приводит к альдегидам и кетонам (реакция Пириа). Электролиз натриевых солей карбоновых кислот позволяет получить соединения, например, алканы, содержащие удвоенное количество заместителей при карбоксиле кислоты (реакция Кольбе). При обсуждении солей карбоновых кислот нельзя не отметить непреходящее значение солей щелочных металлов высших жирных кислот (стеарата натрия) в качестве моющих средств.
1.3.2. Образование ацилгалогенидов. Галогенангидриды карбоновых кислот.
Галогенангидриды карбоновых кислот, чаще всего хлорангидриды, легко получаются при взаимодействии кислот с трех- или пятихлористым фосфором, тионилхлоридом и фосгеном
Из всех производных карбоновых кислот, ацилгалогениды проявляют наибольшую реакционную способность. Это связано с высокой подвижностью галогена в этих соединениях. Реакции галогенангидридов протекают как реакции нуклеофильного замещения галогена и приводят к получению других производных кислот
Во всех этих реакциях в молекулу вводится кислотный остаток – ацил, поэтому их общее название – реакции ацилировния. Галогенангидриды карбоновых кислот являются лучшими ацилирующими средствами. реакция начинается с нуклеофильного присоединения к карбонильной группе в галогенангидриде, как и в случае альдегидов и кетонов
Промежуточный продукт присоединения нуклеофила к галогенацилу отщепляет атом галогена, генерирует карбонильную группу и дает продукт замещения
Нуклеофильное замещение в галогенацилах – кажущееся. На самом деле реакция происходит как «присоединение – отщепление». Атом галогена в галогенангидридах замещается не потому, что он подвижен, а потому что входит в состав функциональной группы, способной к реакции присоединения.
1.3.3. Образование ангидридов.
Общим методом получения ангидридов является взаимодействие солей кислот с галогенангидридами
К ангидридам ведет также реакция карбоновых кислот с галогенацилами в присутствии пиридина Наконец, отметим, что ангидриды получаются и из карбоновых кислот и кетена
Ангидриды кислот, как и галогенацилы, используются в реакциях ацилирования. Ангидриды кислот относятся к мягкодействующим реагентам, при их использовании не выделяется агрессивная хлористоводородная кислота как при применении галогенацилов. При ацилировании ангидридами кислот, которое протекает аналогично только что рассмотренной реакции с участием галогенацилов, получаются другие производные карбоновых кислот
1.3.4. Этерификация. Сложные эфиры.
К сложным эфирам ведет реакция между карбоновыми кислотами и спиртами в присутствии кислотного катализатора, которая называется реакцией этерификации
Приведенный вариант реакции обычно носит название этерификации по Фишеру (Фишер, 1895 г.). Этерификация подвержена влиянию пространственных факторов. Если вблизи реакционного центра участников реакции имеются объемистые группы, то скорость этерификации замедляется. Этерификация по Фишеру протекает как нуклеофильное ацильное замещение по механизму «присоединения – отщепления»
При ацилировании спиртов вместо карбоновой кислоты часто используют более реакционноспособные галогенацилы и ангидриды кислот
В тех случаях, когда в силу тех или иных причин, синтез сложных эфиров ацилированием затруднен, используют другие методы: замещение галогена в галогеналкилах на карбоксилат – анион с помощью серебряных солей карбоновых кислот или прямым присоединением кислот к активным алкенам:
Известен также метод получения метиловых эфиров реакцией карбоновых кислот с диазометаном в эфирном растворе
Сложные эфиры способны к многочисленным превращениям. 1.3.4.1. Гидролиз. При взаимодействии с водой сложные эфиры гидролизуются.
Механизме гидролиза предполагается течение реакции с разрывом связи ацил – кислород. Это было установлено на основании результатов опытов по гидролизу сложного эфира водой, содержащей изотоп кислорода О18
Оказалось, что в ходе гидролиза изотоп кислорода включается в состав карбоновой кислоты. Это однозначно свидетельствует о протекании реакции гидролиза с разрывом связи кислород – ацил. В отличие от этерификации, гидролиз сложных эфиров катализируется и основаниями (омыление). На основании стереохимических исследований и результатов опытов с использованием О18 было установлено, что и в данном случае реализуется механизм «присоединения – отщепления», протекающий с разрывом ацил – кислородной связи
Кислотный катализатор катализирует как этерификацию, так и обратную реакцию – гидролиз. Основный катализатор – только гидролиз. Возникает вопрос, почему основный катализатор не катализирует этерификацию? 1.3.4.2. Переэтерификация. При взаимодействии сложного эфира с избытком спирта в присутствии кислот или оснований происходит замена одного алкила в эфире на другой. Из одного эфира получается другой, происходит переэтерификация
В качестве другого примера укажем на использование переэтерификации для получения поливинилового спирта, который невозможно получить напрямую полимеризацией винилового спирта. При переэтерификации метанолом полимер дает устойчивый поливиниловый спирт и метилацетат
1.3.4.3. Реакция с реактивом Гриньяра. Эта реакция уже упоминалась как метод получения третичных спиртов. Она протекает в согласии с общей схемой как нуклеофильное замещение через нуклеофильное присоединение алкильной группы реактива Гриньяра к электронодефицитному углероду карбонильной группы эфира. Образующийся при этом анион I может реагировать с Mg+Br с образованием алкоголята II или же элиминировать алкоксигруппу c превращением в кетон.
Отличительной особенностью синтеза третичных спиртов рассматриваемым способом является то, что при этом получаются спирты с двумя одинаковыми углеводородными остатками при углероде гидроксильной групп. Применение в реакции с реактивами Гриньяра формиатов позволяет получать вторичные спирты.
1.3.4.4. Аммонолиз. Реакция сложных эфиров с аммиаком В этом случае уходящая алкокси-группа замещается на амино-группу и образуется амид карбоновой кислоты
1.3.4.5. Восстановление. В результате восстановления сложных эфиров, сопровождаемого разрывом связи между кислородом и кислотным остатком, получается два спирта.
Восстановление можно вести атомарным водородом, используя металлический натрий и низкокипящий спирт (метод Буво и Блана)
В последнее время восстановление предпочитают вести алюмогидридом лития
В промышленности гидрогенолиз чаще всего проводят в каталитическом варианте молекулярным водородом под давлением. В качестве катализатора хорошо зарекомендовал себя хромит меди (смесь окислов примерного состава CuO.CuCr2O4).
1.3.4.6. Сложноэфирная конденсация. Сложные эфиры, имеющие водородные атомы у углерода по соседству с карбоксильной группой, в присутствии алкоголятов способны вступать в реакцию конденсации (Кляйзен)
В этом эфире водородные атомы метиленовой группы, находящиеся между двумя карбонилами, становятся кислыми настолько, что становится возможным вытеснение ацетоуксусным эфиром– этанола – из его соли с образованием натрацетоуксусного эфира
1.3.4.7. Сложные эфиры составляют основу таких важнейших природных продуктов как жиры и масла – это эфиры глицерина и предельных и непредельных неразветвленных карбоновых кислот с числом углеродных атомов от 3 до 18. Эти кислоты в основном состоят из четного числа углеродных атомов, из нечетных встречаются только кислоты с тремя и пятью углеродами. Жиры и масла – сложная смесь глицеридов, например, то, что, называют сливочным маслом, является глицеридом 14 карбоновых кислот (состав жиров и масел – табл.1.3.4). Твердые при комнатной температуре глицериды относят к жирам, жидкие – к маслам жиры давно уже используются в качестве исходного продукта при получении соли карбоновых кислот и щелочных металлов (мыла) Они получаются при щелочном гидролизе жиров. Поскольку процесс приводит к мылам, то его называют омылением
Соединения, в которых гидроксил карбоксильной группы замещен на остаток аммиака – амино-группу – или на замещенную амино-группу, называются амидами. Амиды должны были бы получаться при взаимодействии карбоновой кислоты с аммиаком. Однако в результате этой реакции получается не амид, а аммонийная соль кислоты
Получение амидов достигается нагреванием соли и удалением воды отгонкой
Без осложнений, быстро и с высоким выходом протекает реакция галогенацилов с аммиаком и его производными
Для синтеза амидов с успехом могут быть использованы ангидриды кислот и сложные эфиры
Подобно прочим производным карбоновых кислот, амиды гидролизуются под каталитическим действием как кислот, так и оснований
И эта реакция протекает как нуклеофильное замещение «через присоединение». Минеральные кислоты ее катализируют, протонируя карбонильный кислород и создав положительный заряд на углероде. Это способствует нуклеофильной атаке этого углерода
Катализ основаниями гидролиза амидов карбоновых кислот протекает по следующей схеме
Важное место занимает расщепление их по Гофману, которое происходит под действием гипохлоритов или гипобромитов. При этом получаются первичные амины с числом углеродных атомов на 1 углерод меньше, чем в исходном амиде
Амиды карбоновых кислот при нагревании с водоотнимающими средствами, например, с пятиокисью фосфора, теряют молекулу воды и превращаются в нитрилы кислот
1.3.6. Нитрилы карбоновых кислот.
Нитрилы, пожалуй, единственные производные карбоновых кислот, не содержащие в своей молекуле карбонильной группы
получения нитрилов – реакция алкилгалогенидов с цианид – ионом, присоединение цианистого водорода к алкинам и карбонильным соединениям, только что рассмотренная дегидратация амидов карбоновых кислот. Большое значение, как метод получения карбоновых кислот, имеет гидролиз нитрилов. Эта реакция идет как в щелочной, так и в кислой среде
В кислой среде нитрилы гидролизуются в две стадии: вначале до амидов и дальше уже амиды до карбоновых кислот
Гидролиз амидов рассматривался в разделе 1.3.5. Из других реакций нитрилов интерес представляет гидрирование в амины, реакции с участием α- водородных атомов, например, алкилирование.
1.3.7. Декарбоксилирование.
Декарбоксилирование - отщепление от молекулы карбоновой кислоты двуокиси углерода и образование углеводорода, содержащего на один углерод меньше, чем исходная кислота
Электролизсолей карбоновых кислот по Кольбе – происходит образование углеводорода с большим числом углеродных атомов
К реакциям декарбоксилирования относится и пиролиз кальциевых или бариевых солей карбоновых кислот по Пириа с образованием карбонильных соединений.
1.3.8. Галогенирование карбоновых кислот в α - положение.
Реакция Геля – Фольгарда – Зелинского протекает при галогенировании кислот в присутствии небольших количеств фосфора
На галоген могут быть замещены и другие α- водородные атомы, если они имеются. Примером может послужить получение трихлоруксусной кислоты.
Реакция Геля – Фольгарда – Зелинского протекает с высоким выходом галогензамещенных кислот. Через α-галогензамещенные кислоты можно получить многие производные карбоновых кислот: окси – и аминокислоты, непредельные кислоты и др.
Лекция №11
2. Непредельные карбоновые кислоты.
Непредельные карбоновые кислоты содержат в своей молекуле двойные или тройные связи и карбоксильные группы. Приведем наиболее часто встречающиеся непредельные кислоты и их названия
СН2=СНСООН акриловая кислота, пропеновая кислота
СН3СН=СНСООН кротоновая кислота, 2-бутеновая кислота цис-СН3(СН2)7СН=СН(СН2)7СООН олеиновая кислота транс-СН3(СН2)7СН=СН(СН2)7СООН элаидиновая кислота СН3(СН2)4СН=СНСН2СН=СН(СН2)7СООН линолевая кислота СН3СН2СН=СНСН2СН=СНСН2СН=СН(СН2)7СООН линоленовая кислота цис-НООССН=СНСООН малеиновая кислота, цис-бутендиовая кислота транс-НООССН=СНСООН фумаровая кислота, транс-бутендиовая кислота
Непредельные карбоновые кислоты, у которых двойная связь и карбоксильная группа удалены друг от друга, проявляют обычные свойства, присущие алкенам и карбоновым кислотам. Поэтому в данном разделе будут рассматриваться лишь такие непредельные карбоновые кислоты, в которых функциональные группы сопряжены и влияют друг на друга
Важнейшим представителем непредельных карбоновых кислот является акриловая кислота. Предложен ряд методов синтеза этой кислоты. По одному из них из этиленхлоргидрина или окиси этилена получают нитрил оксипропионовой кислоты, который при кислотном гидролизе, сопровождаемой дегидратацией, превращается в акриловую кислоту
Другие методы синтеза акриловой кислоты основываются на превращениях ацетилена.При этом или присоединением синильной кислоты получают акрилонитрил и его гидролизуют, или используют реакцию оксосинтеза
Обычный путь получения метакриловой кислоты – присоединение синильной кислоты к ацетону с последующим гидролизом и дегидратацией полученного циангидрина
Еще один представитель непредельных кислот – кротоновая кислота - может быть получена окислением кротонового альдегида, являющегося продуктом кротоновой конденсации ацетальдегида. Эту кислоту можно получить также по реакции Кневенагеляконденсацией ацетальдегида с малоновой кислотой в присутствии пиридина с последующим декарбоксилированием замещенной малоновой кислоты
Характерным свойством соединений, содержащих двойную углерод – углеродную связь, является способность вступатьв реакции присоединения. При этом раскрывается слабая π- связь ивместо неевозникают две прочные σ- связи., Непредельные карбоновые кислоты вступают в реакции электрофильного присоединения, однако хуже, чем алкены. Они вступают также в реакции нуклеофильного присоединения. Электрофильное присоединение. Рассмотрим реакцию акриловой кислоты с хлористым водородом. Если первую стадию этой реакции – протонирование – представить себе просто как присоединение протона к углероду двойной связи, то в результате возможно образование ионов I и II. Судить относительно устойчивости этих ионов довольно сложно. Если - I первичный, то II, хотя и вторичный, однако дестабилизирован соседней карбоксильной группой
Акриловая кислота представляет собой сопряженную систему двойных связей как в молекуле бутадиена. В соответствии со своим строением акриловая кислота может протонироваться по концевым атомам сопряженной системы с образованием вновь II и резонансно стабилизированного карбокатиона, представленного структурами III и IV
Последующее присоединение к IV аниона хлора даст енольную форму продукта реакции, вступающую в таутомерные отношения со своей кето – формой
По современным представлениям правило Марковникова трактуется как ионное присоединение к С=С – связи, протекающее с образованием более стабильного карбокатиона. Именно это и происходит при электрофильном присоединении к α, β- непредельным карбоновым кислотам. Также протекают и другие реакции рассматриваемого типа, например, гидратация
Таким образом, карбоксильная группа при двойной связи не только снижает ее реакционную способность по отношению к электрофильным реагентам, но и влияет на направление присоединения. Нуклеофильное присоединение. Благодаря активирующему влиянию карбоксильной группы, α, β - непредельные карбоновые кислоты весьма охотно вступают в реакции нуклеофильного присоединения. Примерами могут послужить присоединение к акриловой кислоте аммиака,гидроксиламина и синильной кислоты
Предполагаемый механизм нуклеофильного присоединения к непредельным карбоновым кислотам следующий
Нуклеофильный реагент присоединяется к концевому атому сопряженной системы с образованием резонансно – стабилизованного карбаниона, который в последующей стадии реакции отрывает протон от молекулы растворителя и превращается в продукт. К числу реакций нуклеофильного присоединения к непредельным карбоновым кислотам относится также реакция Михаэля, представляющая собой присоединение карбаниона к α, β - ненасыщенным соединениям. В качестве примера приведем реакцию этилкротоната с этилметилмалонатом и реакцию этилметакрилата с этилцианацетатом в присутствии этилата натрия
Частным случаем реакции Михаэля является использование в качестве непредельной компоненты акрилонитрила, который в щелочной среде способен присоединять целый ряд соединений с подвижным водородным атомом. Это позволяет расширить возможности синтетической органической химии. Вот несколько примеров реакций с акрилонитрилом
Во всех этих реакциях присоединение идет к β - углеродному атому акрилонитрила и в молекулу вместо активного водорода вводится группировка атомов -СН2СН2СN.По этому признаку рассматриваемую реакцию часто называют реакцией цианэтилирования. Особая значимость непредельных карбоновых кислот и их производных заключается в их способности полимеризоваться в ценные продукты. Акрилонитрил при полимеризации дает полимер, из которого изготавливают химические волокна – заменители шерсти. При сополимеризации акрилонитрила с бутадиеном получаются масло – и бензостойкие синтетические каучуки. Широко известны также полимеры метиловых эфиров акриловой и метакриловой кислот, представляющие собой бесцветные, прозрачные материалы, способные формоваться. Их еще называют органическими стеклами
Лекция №12
3. Дикарбоновые кислоты.
Предельные дикарбоновые кислоты в своей молекуле содержат две карбоксильные группы. Свое название они получают чаще всего по тривиальной номенклатуре. По систематической номенклатуре наличие двух карбоксилов в кислоте отображается добавлением окончания диовая кислотак названию углеводорода, которому в данном соединении соответствует наиболее длинная цепь углеродных атомов. Ниже приводятся наиболее часто встречающиеся дикарбоновые кислоты и их названия
НООС-СООН щавелевая кислота, этандиовая кислота НООС-СН2-СООН малоновая кислота, пропандиовая кислота НООС-(СН2)2-СООН янтарная кислота, бутандиовая кислота НООС-(СН2)3-СООН глутаровая кислота, пентандиовая кислота НООС-(СН2)4-СООН адипиновая кислота, гександиовая кислота НООС-(СН2)5-СООН пимелиновая кислота, гептандиовая кислота НООС-(СН2)6-СООН пробковая кислота, октандиовая кислота НООС-(СН2)7-СООН азелаиновая кислота, нонандиовая кислота НООС-(СН2)8-СООН себациновая кислота, декандиовая кислота
Для получения двухосновных кислот используются те же методы, что и для синтеза кислот одноосновных: окисление первичных спиртов и альдегидов, гидролиз нитрилов и производных кислот и др. Чтобы не повторяться, мы их рассматривать не будем. Значительно интереснее приложение общих методов к синтезу конкретных кислот, а также использование особых методов получения. Щавелевая кислота. В виде солей встречается во многих растениях (в щавеле, кислице). В технике получается нагреванием до 4000 натриевой или калиевой соли муравьиной кислоты
Любопытно отметить, что первый синтез щавелевой кислоты гидролизом дициана был предложен Велером еще в 1824 году
Малоновая кислота. Обычный путь синтеза этой кислоты, играющей особую роль в органическом синтезе, заключается в гидролизе ее мононитрила
Могут быть использованы и другие методы, например, превращение хлористого метилена в динитрил и его гидролиз, использование магнийорганического синтеза. Янтарная кислота получается обычно гидрированием малеинового ангидрида – продукта окисления бензола. Как и при синтезе малоновой кислоты, может быть использован также гидролиз динитрила. Сам динитрил получается при нуклеофильном замещении 1,2-дихлорэтана
Адипиновая кислота в технике в больших количествах получается окислением циклогексана азотной кислотой в одну стадию или же через промежуточные продукты окисления - циклогексанол и циклогексанон, которые окисляются еще легче
По своим химическим свойствам двухосновные кислоты близки к кислотам одноосновным. Они образуют все известные производные кислот с участием одной (кислые производные) или же обеих карбоксильных групп (полные производные). Однако взаимное влияние двух карбоксилов, особенно когда они расположены близко друг к другу, приводит к появлению специфических особенностей в их поведении в химических реакциях. Рассмотрим эти особенности. 3.1. Кислотность. Понятно, что двухосновные кислоты имеют две константы кислотности, связанные с диссоциацией одной или другой карбоксильной группы
При диссоциации одной из карбоксилов другая выступает просто как электроноакцепторная группа. При обсуждении кислотности монокарбоновых кислот (раздел 1.3.1) было установлено, что такие заместители усиливают кислотные свойства. По этой причине первая константа кислотности (К1) у двухосновных кислот гораздо выше, чем у одноосновных кислот. В то же время вторая константа кислотности (К2) существенно ниже, потому что при ионизации второго карбоксила протон приходится удалять из дважды заряженного аниона. Приводимые ниже данные позволяют обсуждать кислотность двухосновных кислот на количественном уровне
Кислота 105К1 105К2 Муравьиная 17,7 - Уксусная 1,75 - Щавелевая 5400 5,2 Малоновая 140 0,20 Янтарная 6,4 0,23 Глутаровая 4,5 0,38 Адипиновая 3,7 0,39
3.2. Поликонденсация. Обычные химические реакции в случае участия в них двухосновных кислот могут привести к получению полимерных молекул. Правда, чтобы это случилось, партнер кислоты по химической реакции должен быть также бифункциональным. Например, реакция уксусной кислоты с этиламином приведет просто к получению этилацетамида
В случае же двухосновной кислоты и диамина появляется возможность вступления в реакцию множества молекул кислоты и амина с образованием полимерного полиамида. При участии в реакции адипиновой кислоты и гексаметилендиамина образуется полиамид (найлон), включающий в себя остатки кислоты и амина, связанные так называемой амидной связью
В отличие от полимеризации, получение полимеров на основе обычных химических реакций, носит название поликонденсации. Поликонденсация всегда сопровождается выделением более простых молекул, в рассмотренном случае воды. 3.3. Отношение к нагреванию. Результат нагревания дикарбоновых кислот определяется их строением. В общем случае, под воздействием тепла молекула кислоты деградируется. При этом выделяются молекулы или двуокиси углерода и образуются одноосновные кислоты, циклические ангидриды и циклические кетоны. Щавелевая и малоновая кислота при нагревании до 140-1500 декарбоксилируются
Глутаровая и янтарная кислоты при нагревании претерпевают внутримолекулярную дегидратацию с образованием циклических ангидридов
Адипиновая и пимелиновая кислоты при нагревании до 3000 декарбоксилируются и циклизуются
4. Оксокислоты.
Оксокислоты содержат в своей молекуле карбоксильную и карбонильную группы. Карбонильная группа может быть представлена альдегидной или кето - группами. По содержанию тех или иных функциональных групп и по их относительному расположению в молекуле одни оксокислоты отличаются от других. Приведем некоторые наиболее часто встречающиеся оксокислоты и их названия
Ацетоуксусная кислота относится к β- оксокислотам. Основным методом получения этой кислоты является конденсация сложных эфиров в присутствии алкоголятов. Эта реакция под названием реакции Кляйзена уже рассматривалась в разделе для получения ацетоуксусной кислоты в виде сложного эфира используется реакция между дикетеном и этиловым спиртом
По своим химическим свойствам ацетоуксусная кислота напоминают кетоны и кислоты. По карбоксильной группе она дает обычные для кислот производные: соли, амиды, сложные эфиры и др.
Более устойчивый, чем сама кислота, сложный эфир ацетоуксусной кислоты по карбонильной группе присоединяет синильную кислоту, бисульфит натрия, водород в момент выделения, фенилгидразин и т. д.
ацетоуксусный эфир и представляет собой непредельный спирт, находящийся в равновесии со своей кето – формой
Во все упомянутые выше реакции ацетоуксусный эфир вступает в енольной форме
Состав кето – енольной смеси ацетоуксусного эфира стал известен благодаря работам немецкого исследователя Кнорра(1911 г). При охлаждении ацетоуксусного эфира до -780 в смеси эфир – гексан Кнорр выделил твердое вещество с т.пл. -390. Это вещество не обесцвечивало бромную воду и не реагировало хлоридом железа. Из этих данных следовало, что вещество с т.пл. -390 представляет собой кето – форму эфира. Реакцией ацетоуксусного эфира с металлическим натрием Кнорр получил натрацетоуксусный эфир. Через суспензию этого вещества в петролейном эфире был пропущен сухой НСl. При этом отделилось масло, которое мгновенно реагировало с бромом и хлоридом железа. Это было енольной формой ацетоуксусного эфира. Таким образом, Кнорру впервые удалось разделить таутомеры
Более того, оказалось, что таутомеры можно было при -780 хранить как таковые длительное время.
Cинтезы на основе ацетоуксусной кислоты. достаточно легко декарбоксилируется при нагревании. При этом получается кетон
ацетоуксусной кислоты используются в органическом синтезе при получении моно- и дизамещенных ацетонов.
5. Оксикислоты.
Оксикислоты содержат в своей молекуле гидроксильные и карбоксильные группы. По числу гидроксилов и карбоксилов в оксикислотах определяется их атомность и основность. Кроме того, оксикислоты различаются также по относительному расположению функциональных групп в молекуле. Ниже приводятся наиболее часто встречающиеся оксикислоты и их названия (без учета стереохимии кислот)
5.1. Методы получения. Как и в случае оксокислот, оксикислоты получаются на основе использования известных уже методов создания соответствующих функциональных групп – гидроксила и карбоксила. α - Оксикислоты обычно синтезируются гидролизом соответствующих циангидринов или гидролизом α - галогензамещенных кислот
Для получения β - оксикислот возможно использование аналогичных способов. Однако для этого имеется и свой специфический метод – реакция Реформатского.Эта реакция заключается вовзаимодействии альдегидов и кетонов с α- бромэфирами и металлическим цинком в эфирном растворе. При этом эфир оксикислоты получается в виде алкоголята, гидролиз которого приводит уже к самой оксикислоте
Установлено, что вначале бромэфир реагирует с цинком с образованием цинкорганического соединения, которое уже дальше присоединяется к карбонильной группе альдегида или кетона
Все это аналогично получению и реакции реактива Гриньяра. Особенностью реакции Реформатского является использование цинка вместо магния и только α - бромэфиров. Оказалось, что цинкорганические соединения в отличие от магнийорганических соединений менее реакционноспособны. Они способны реагировать лишь с карбонилами альдегидов и кетонов, не затрагивая сложноэфирную группу.
5.2. Химические свойства. Оксикислоты проявляют свойства, присущие спиртам и кислотам. По карбоксильной группе они дают все производные карбоновых кислот
Реагируя как спирты, они дают алкоголяты, простые эфиры, замещают гидроксил на галоген
Иногда возникает конкуренция между функциональными группами. В таких случаях региоселективность реакции определяется выбором реагента и условиями реакции. Так, при действии галогенводородов на галоген замещается только спиртовой гидроксил. В случае же применения пятихлористого фосфора – и спиртовой, и карбоксильный гидроксилы. Весьма интересным представляется рассмотрение проблемы взаимного влияния функциональных групп на реакционную способность и направление реакции в случае оксикислот. α - Оксикислоты легко восстанавливаются до карбоновых кислот
При нагревании с кислотами α - оксикислоты легко отщепляют муравьиную кислоту
Результат дегидратации оксикислот зависит от взаимного расположения гидроксильной и карбоксильной групп. β - Оксикарбоновые кислоты элиминируют воду таким образом, что в результате реакции получаются α, β - ненасыщенные карбоновые кислоты, в которых С=С- и С=О-связи сопряжены
α - Оксикислоты при нагревании отщепляют воду в результате взаимной этерификации двух молекул с образованием циклических сложных эфиров, называемых лактидами
Наконец, отметим, что γ - и δ - оксикислоты при нагревании претерпевают внутримолекулярную этерификацию. При этом образуются пяти- и шестичленные циклические сложные эфиры, называемые γ - и δ -лактонами
Оксикислоты (винные кислоты) сыграли выдающуюся роль при открытии явления энатиомерии и изучении закономерностей этого вида пространственной изомерии. В 1848 году Луи Пастер, изучая винные кислоты, обнаружил, что натрийаммониевый тартрат (тартраты - соли винной кислоты) одной из них при кристаллизации из разбавленных водных растворов образует два типа кристаллов. Эти кристаллы выделенной из виноградного сока кислоты, названной виноградной или рацемической (лат. racemus – виноград) кислотой, отличались весьма незначительно, как предмет и его зеркальное изображение. Тем не менее, Пастеру удалось их разделить и показать, что кристаллы одного типа вращают плоскость поляризованного света вправо, другого типа – влево. Эти исследования дали возможность установить, что изомерные винные кислоты бывают правовращающей и левовращающей. Смесь, состоящая из равных количеств этих кислот, называется рацемической. Такая смесь (виноградная кислота) не способна вращать плоскости поляризованного света из-за компенсации вращения изомерами. Кроме того, известен еще один изомер винных кислот (мезовинная кислота), представляющий собой внутренний рацемат. В этом случае вращение света верхней частью молекулы уничтожается противоположным по знаку и равным по величине вращением нижней части молекулы. Графически изомеры винных кислот можно изобразить следующими проекционными формулами:
|

























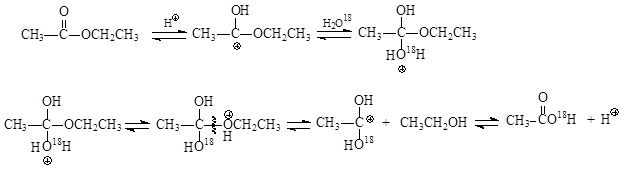











 1.3.5. Амиды карбоновых кислот.
1.3.5. Амиды карбоновых кислот.








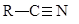


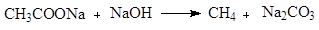

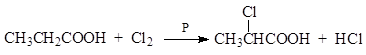




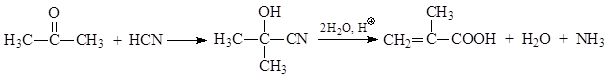






















 Оксокислоты относятся к бифункциональным соединениям. При обсуждении методов их синтеза вполне обоснованно можно опираться на уже известные сведения по созданию карбонильной и карбоксильной групп. То же самое может быть сказано и относительно свойств оксокислот. Это позволяет рассматривать оксокислоты на примере лишь одной из них, правда, самой известной – ацетоуксусной кислоты и ее этилового эфира.
Оксокислоты относятся к бифункциональным соединениям. При обсуждении методов их синтеза вполне обоснованно можно опираться на уже известные сведения по созданию карбонильной и карбоксильной групп. То же самое может быть сказано и относительно свойств оксокислот. Это позволяет рассматривать оксокислоты на примере лишь одной из них, правда, самой известной – ацетоуксусной кислоты и ее этилового эфира.