 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Дисоціація води. Йонний добуток води. 12
Чиста вода є слабким електролітом, який незначною мірою проводить електричний струм. Спрощенно рівняння дисоціації води можна записати: Н2О ↔ Н+ + ОН-. Застосувавши до рівноваги закон діючих мас, матимемо: К = де К- константа електролітичної дисоціації води.Оскільки ступінь дисоціації води дуже малий,то практично[Н2О] = const і тоді К (Н2О) = [Н+][ОН-]. Константа К(Н2О) називається йонним добутком води, яка при 220С дорівнює 1·10-14. Водневий показник. При кімнатній температурі (22 °С) нейтральні розчини мають однакову концентрацію: [Н+] = [ОН-] = 10-7 моль/л, так як Кн2о=1·10-14. Таке саме значення Кн2омають при цій температурі і водні розчини кислот і основ. Тому, якою б великою не була концентрація іонів водню, концентрація гідроксид-іонів не матиме нульового значення або навпаки. Це дає змогу обчислювати концентрацію [Н+] або [ОН-] якщо одна з цих величин відома. Проте записувати концентрації іонів Н+ або ОН- через від'ємний ступінь не зовсім зручно. Ось чому кислотні властивості розчинів датський біохімік С. Серенсен (1909 р.) запропонував характеризувати величиною водневого показника рН, який визначається за співвідношенням рН = - lg [Н+] Оскільки концентрація іонів водню може змінюватись у межах іонного добутку, то рН змінюється в інтервалі від нуля до чотирнадцяти. У нейтральному розчині [Н+] = 10-7 моль/л; рН = - Ig10-7 = 7. У кислому розчині [Н+] > 10-7 моль/л; рН < 7. У лужному середовищі [Н+] < 10-7 моль/л; рН > 7. Реакції у розчинах електролітів. Іонні рівняння Згідно з теорією електролітичної дисоціації, реакції у розчинах електролітів відбуваються між іонами. Реакції між іонами відбуваються лише тоді, коли внаслідок їхньої взаємодії утворюється малорозчинна або летка сполука або слабкий електроліт.. Розглянемо приклади утворення малорозчинних продуктів реакції. Якщо до розчину нітрату барію добавити розчин сульфату калію або іншої солі, яка у своєму складі має сульфат-іон (наприклад, сульфат амонію, натрію), то випадає білий осад сульфату барію. Замість розчину солі можна добавити сірчану кислоту. Запишемо кілька рівнянь реакцій утворення сульфату барію: Ва (N03)2 + K2S04 = BaS04↓ + 2KNO3; Ba (N03)2 + Na2S04 = BaS04↓ + 2NaN03; Ba (NO3)2 + H2S04 = BaS04↓+ 2HN03. Наведені рівняння свідчать проте, що утворення малорозчинного у воді сульфату барію є наслідком взаємодії лише двох іонів Ва2+ і S042-. Справді, якщо записати добре розчинні і сильні електроліти для всіх трьох рівнянь реакції утворення BaS04 у вигляді іонів і скоротити однакові іони в цих рівняннях, то можна бачити, що фактично реакція відбувається між іонами Ва2+ і S042-, а всі інші іони ніяких змін не зазнають. Наприклад: Ва2+ + 2N03- + 2К+ + SO42- = BaS04 ↓ + 2K+ + 2NO3-; Ва2+ + SO42- = BaS04 ↓. Ці рівняння є іонно-молекулярними рівняннями утворення сульфату барію. Повним йонно-молекулярним і скороченим йонно-молекулярним рівняннями. Прикладом реакції з утворенням леткої речовини є реакція взаємодії сульфіду калію і хлороводневої кислоти, оскільки розчинність сірководню у воді незначна і при нагріванні розчину різко зменшується: K2S + 2НС1 = 2КС1 + H2S↑; 2К+ + S2- + 2Н+ + 2СГ = 2К+ + 2СГ + H2S↑; 2Н+ + S2- = H2S↑. Приклади утворення малодисоційованої сполуки - це звичайні реакції нейтралізації, які є зворотними відносно реакції дисоціації води, і утворення слабкої кислоти або слабкої основи: 2NaC10 + H2S04 = Na2S04 + 2НС10; C10- + H+ = HC10. NH4Br + KOH = KBr + NH3 • НаО; NH4+ + О Н- = NH3 • Н20 Гідроліз солей Електролітична дисоціація води на іони водню і гідроксилу спричинює те, що вони можуть утворювати з іонами солей слабкі або малорозчинні електроліти. Внаслідок цього концентрація іонів води змінюється і багато які розчини середніх солей мають кислу або лужну реакцію. рН розчинів таких солей може бути більше або менше семи. Взаємодія солі з водою, яка призводить до утворення слабкого або погано розчинного електроліту, називається гідролізом солі. Гідроліз можна визначити як реакцію обмінного розкладання солі водою або як процес, обернений реакції нейтралізації. Отже, гідроліз - це рівноважний процес і можна створити умови, за яких сіль гідролізувати не буде. Гідроліз солі є окремим випадком взаємодії іонів солі з розчинником - водою. Взаємодія солі з розчинником, що супроводиться утворенням слабкого електроліту, називається сольволізом. Гідролізу зазнають солі, що утворюються за участю слабких кислот і основ. Солі, які є похідними сильних кислот і основ, не гідролізують, оскільки їх іони (катіони й аніони) не зв'язують іони води (ОН- або Н+), а отже, і не зміщують її іонну рівновагу. Тому розчини таких солей, як NaC104, KСІ, KN03, Na2S04, СаС12, Ba (N03)2 не гідролізують, їх розчини нейтральні (рН = 7). Залежно від типу солі механізм гідролізу останньої може бути різним. У водному розчині катіони гідратуються за рахунок донорно-акцепторного, а аніони — за рахунок водневого зв'язку. Розглянемо типові випадки гідролізу солей. 1. Сіль, утворена слабкою основою і сильною кислотою. Це найпоширеніший випадок, оскільки більшість гідроксидів металів, зокрема багатовалентних, є слабкими основами. Солі слабких основ і сильних кислот гідролізують з утворенням слабкої основи (якщо це сіль однокислотної основи) або основних солей. При цьому утворюється вільна сильна кислота, а розчини таких солей мають кислу реакцію (рН < 7). Наприклад, гідроліз NH4C1 відбувається відповідно до рівнянь: NH4C1 + Н20 ↔ NH3 ·Н20 + HC1; NH4+ + СІ- + H20 ↔ NH3 • H20 + Н+ + СІ-; NH4+ + Н20 ↔ NH3 • Н20 + Н+. Іони NH4+ взаємодіють з іонами гідроксилу води, утворюючи слабкий електроліт NH3·H20. Іони водню води не утворюють з іонами СІ- молекул, оскільки НСІ - це сильний електроліт. Отже, у розчині створюється певний надлишок іонів водню і тому розчин NH4C1 має кислу реакцію. Подібно, проте ступінчасто, гідролізують солі, утворені багатокислотними слабкими основами. При цьому гідроліз солі відбувається переважно за першим ступенем: ВіСІ3 + Н20 ↔ Ві (ОН) СІ2 + HC1; Ві3+ + Н20 ↔ ВіОН2+ + Н+ (перший ступінь); Ві (ОН) С12 + Н20 ↔ Ві (OH)2СІ + HC1; Ві (ОН)2+ + Н20 ↔ Ві (ОН)2+ + H+ (другий ступінь); Ві (ОН)2СІ + Н20 ↔ Ві (0Н)3 + НСІ; Ві (OH)2+ + H20 ↔ Ві(ОН)3 + Н+. Такі самі рівняння реакцій гідролізу можна записати для солей AlСІ3, FeCl3, Fe (C104)3 та ін. Оскільки гідроліз солі є оборотним процесом, то, щоб запобігти її гідролізу (змістити рівновагу вліво), до розчину треба добавити відповідну кислоту, наприклад НСІ (при гідролізі хлоридів металів). 2. Сіль, утворена слабкою кислотою і сильною основою. Прикладом таких солей є KCN, СН3СООК, К2С03, Na2S, К3Р04 та ін. Запишемо рівняння гідролізу деяких з них: KCN + Н20 ↔ HCN + КОН; CN- + Н20 ↔ HCN + ОН-. Як видно, внаслідок гідролізу солі утворюється деякий надлишок іонів ОН- і тому розчини солей, утворених сильною основою і слабкою кислотою, мають лужну реакцію (рН >7). Солі багатоосновних кислот гідролізують ступінчасто: К2С03 + Н20 ↔ КНС03 + КОН; CO32- + Н2О ↔ НСО3- + ОН- (перший ступінь); КНСО3 + На0 ↔ Н2С03 + КОН; НСО3- + Н20 ↔ Н2С03 + ОН- (другий ступінь). Отже, солі, що складаються з аніонів слабких кислот і катіонів сильних основ, гідролізують з утворенням слабкої кислоти або кислої солі. Зміщення рівноваги гідролізу вліво в бік утворення середньої солі можна здійснити, добавляючи до розчину солі розчин відповідного лугу. 3. Сіль, утворена слабкою основою і слабкою кислотою. Гідроліз таких солей відбувається досить повно, оскільки внаслідок гідролізу утворюються дві малодисоційовані або малорозчинні речовини. Багато які солі цього типу гідролізують необоротно. Прикладом повного гідролізу солі є взаємодія сульфіду алюмінію з водою: A12S3 + 6Н20 = 2А1 (ОН)3 ↓ + 3H2S↑.
3. Лабораторна робота. «Реакції в розчинах електролітів» Дослід 1. Зміщення рівноваги в бік утворення газоподібних та малодисоційованих сполук. А) До 1 мл розчину натрій карбонату додайте 1 мл розчину нітратної кислоти ( 2,0 н). Що спостерігаєте? Напишіть рівняння реакції в молекулярній та йонно-молекулярній формах. Б) До 1 мл розчину натрій карбонату додайте 1 мл розчину нітратної кислоти ( 2,0 н). Що спостерігаєте? Напишіть рівняння реакції в молекулярній та йонно-молекулярній формах. В) До 1 мл розчину калій гідроксиду додайте 1-2 краплі фенолфталеїну, потім долийте розчин нітратної кислоти (0,5 н) до зникнення забарвлення індикатору. Напишіть рівняння реакції в молекулярній та йонно-молекулярній формах. Дослід 2. Зміщення рівноваги в бік утворення важкорозчинних сполук. А) В чотири окремі пробірок налийте по 1 мл розчинів натрій хлориду, калій хлориду, кальцій хлориду, алюміній хлориду. Потім в кожну пробірку додайте по 1-2 краплі розчину арґентум нітрату. Що спостерігаєте? Напишіть рівняння реакцій в молекулярній та йонно-молекулярній формах. Б) В чотири окремі пробірок налийте по 1 мл розчинів натрій сульфату, калій сульфату, купрум сульфату, алюміній сульфату. Потім в кожну пробірку додайте по 1-2 краплі розчину барій нітрату або хлориду. Що спостерігаєте? Напишіть рівняння реакцій в молекулярній та йонно-молекулярній формах. В) У три окремі пробірки налийте по 1 мл розчину плюмбум нітрату. Потім у пробірки додайте по 1-2 краплі розчинів солей: у першу – калій йодиду; у другу – калій хромату; у третю – натрій сульфіду. Що спостерігаєте? Напишіть рівняння реакцій в молекулярній та йонно-молекулярній формах.
12 |



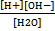 , або [Н+][ОН-] = К[Н2О],
, або [Н+][ОН-] = К[Н2О],