 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Групповые реакции катионов по кислотно-основному методу
Например 1. Обнаружение
2. Обнаружение
Мешающим ионом является
Красная окраска раствора «забивает» синий цвет и обнаружение § Маскировка комплексообразованием заключается в переводе
или оксалатных комплексов
которые не мешают определению кобальта с тиоцианатом. § Маскировка восстановлением
Систематический анализ применяют, если анализируемый раствор является сложным по качественному составу и дробный анализ невозможен из-за наличия большого количества мешающих ионов. В этом случае применяют систематический метод анализа. Систематический метод качественного анализа основан на том, что сначала с помощью групповых реагентов разделяют смесь ионов на группы и подгруппы, а затем в пределах этих подгрупп обнаруживают каждый ион с использованием качественных реакций. В зависимости от вида групповых реагентов различают различные методы систематического анализа: сероводородный, кислотно-основной, аммиачно-фосфорный и другие. Для студенческого практикума предлагается использовать, как более простой и наглядный, систематический анализ катионов кислотно-основным методом. При этом состав анализируемых растворов упрощен и ограничен наиболее часто встречающимися элементами, содержащимися в полиметаллических рудах цветных металлов, продуктах их обогащения, соответствующих полупродуктах, отходах производств, сточных и рудничных водах, характерных для предприятий, работающих по профилю специальностей Санкт-Петербургского государственного горного института. Поэтому в настоящем руководстве рассмотрены растворы, которые содержат только следующие катионы: 1. Систематический анализ катионов кислотно-основным методом В качестве групповых реагентов кислотно-основного метода анализа применяют соляную и серную кислоты, щелочи и гидроксид аммония. Кислотно-основной метод анализа основан на выделении шести аналитических групп: I группа содержит II группа содержит
По этому принципу группа называется хлоридной. III группа содержит
По этому признаку группа называется сульфатной. Сульфат кальция более растворим, чем сульфат бария и для уменьшения его растворимости добавляют при нагревании этиловый спирт или ацетон. IV группа содержит При действии избытка щелочи на ионы Zn2+, Al3+, Cr3+ образуются гидроксокомплексы этих металлов:
где n = 4 или 6, Ме - Zn, Al, Cr. При недостатке щелочи при рН = 5-11 образуются осадки гидроксидов этих металлов:
которые растворяют при добавлении щелочи:
Хром (III) обычно в ходе анализа окисляют пероксидом водорода в щелочной среде до хромата, в котором хром шестивалентен:
Действием гидроксида натрия достигается разделение катионов IV и V групп. Элементы IV группы в щелочной среде остаются в растворе в виде гидроксокомплексов, а катионы V группы выпадают в осадок с образованием соответствующих гидроксидов. V группа содержит
С помощью гидроксида аммония достигается также разделение катионов IV и VI групп. Примечание: гидроксид магния осаждают в сильнощелочной среде при рН>11,5, что требует добавления раствора VI группа содержит
Схема разделения анализируемого раствора на выделенные группы катионов в соответствии с их составом и групповыми реакциями приведена на рис. 1. Чтение и понимание такого рода схем является особенно полезным для студентов металлургических, обогатительных и экологических специальностей, технологическую основу которых составляют различные процессы разделения компонентов (минералов, ионов и т.д.). Групповые реакции катионов по кислотно-основному методу Систематический анализ применяют, если анализируемый раствор является сложным по качественному составу и дробный анализ невозможен из-за наличия большого количества мешающих ионов. В этом случае применяют систематический метод анализа. Систематический метод качественного анализа основан на том, что сначала с помощью групповых реагентов разделяют смесь ионов на группы и подгруппы, а затем в пределах этих подгрупп обнаруживают каждый ион с использованием качественных реакций.
I группа содержит II группа содержит Ход анализа: В одну пробирку отобрать несколько капель соли серебра, во вторую – свинца (II), в третью – ртути (I). К каждой пробирке прилить 1-2 капли соляной кислоты. Наблюдать образование осадков хлоридов металлов. К пробирке, содержащей осадок хлорида свинца прилить немного горячей воды. Произойдет растворение осадка. Реакция позволяет отделить катионы свинца от ионов ртути и серебра. К пробирке, содержащей осадок хлорида серебра добавить избыток аммиака. Произойдет растворение осадка хлорида серебра за счет образования растворимого аммиачного комплекса серебра [Ag(NH3)2]+. Данная реакция позволяет отделить ионы серебра от ионов свинца и ртути. III группа содержит Ход анализа: В пробирку отобрать несколько капель соли кальция и прилить 1-2 капли серной кислоты. Без добавления ацетона осадок сульфата кальция не образуется. Добавить ацетон, хорошо перемешать – начнется выпадение осадка CaSO4. В другую пробирку отобрать несколько капель соли бария, прилить 1-2 капли серной кислоты и наблюдать образование кристаллического осадка сульфата бария. IV группа содержит Ход анализа. В три пробирки отобрать соль алюминия, соль цинка и соль хрома соответственно. В каждую пробирку осторожно прибавлять разбавленную щелочь до образования осадка гидроксида металла. Полученные осадки растворить при добавлении нескольких капель крепкого раствора щелочи. Хром (III) обычно в ходе анализа окисляют пероксидом водорода в щелочной среде до хромата, в котором хром шестивалентен: Действием гидроксида натрия достигается разделение катионов IV и V групп. Элементы IV группы в щелочной среде остаются в растворе в виде гидроксокомплексов, а катионы V группы выпадают в осадок с образованием соответствующих гидроксидов. Ход анализа. В пробирку налить по 2-3 капли солей железа и хрома. Добавить избыток крепкого раствора щелочи и отфильтровать. Наблюдать разделение железа (III) – в осадке – и хрома (III) – в фильтрате, в окрашенном в зеленый цвет растворе. V группа содержит Ход анализа. В три пробирки налить по 2-3 капли соли железа (III) марганца (II) и магния соответственно. К каждой пробирке добавить несколько капель гидроксида аммония. Наблюдать образование осадков гидроксидов металлов. Примечание: гидроксид магния осаждают в сильнощелочной среде при рН>11,5, что требует добавления раствора VI группа содержит Ход анализа. В разные пробирки отобрать по несколько капель солей никеля, меди, кадмия, кобальта, ртути (II). В каждую пробирку налить избыток гидроксида аммония. Наблюдать образование аммиачных комплексов указанных металлов. Отметить цвет образующихся аммиакатов. С помощью гидроксида аммония достигается также разделение катионов IV и VI групп. В пробирку отобрать по 2-3 капли растворов солей железа и меди. Добавить избыток аммиака. Отфильтровать. В пробирку прилить по 2-3 капли растворов солей меди и магния. Добавить избыток аммиака, а затем – несколько капель щелочи. Образуется белый осадок гидроксида магния, хорошо заметный на синем фоне раствора аммиаката меди.
2. Качественные аналитические реакции катионов 2.1. первая аналитическая группа катионов 2.1.1. Катион Определяется по обменной реакции с дигидроантимонатом калия, образующим с водным раствором соли натрия в нейтральной среде (pH~7) белый кристаллический осадок дигидроантимоната натрия:
Примечание: при рН<7 выпадает белый аморфный осадок сурьмяной кислоты Ход анализа. В пробирку внести 2-3 капли раствора соли натрия и прибавить равный объем реактива. Для улучшения выпадения осадка можно потереть внутренние стенки пробирки стеклянной палочкой, охладить реакционную смесь. 2.1.2. Катион Определяется по реакции с гексанитрокобальтатом (III) натрия, образующим с водным раствором соли калия в слабокислой среде (рН=4-6) желтый осадок двойной комплексной соли - гексанитрокобальтата (III) натрия-калия:
2.1.3. Катион Реактив Несслера, который является щелочным раствором комплексной соли Аналитическая реакция протекает по следующему уравнению:
Ход анализа. К 2-3 каплям раствора соли аммония добавить 4-6 капель (избыток) реактива Несслера (2 K2[HgI4](aq)+4 KOH). При малых количествах иона аммония («следы») осадок приобретает желтое окрашивание. 2.2. Вторая аналитическая группа катионов 2.2.1.Катион Определяется по обменной реакции с хлоридом натрия (или соляной кислотой) с образованием белого осадка хлорида серебра:
При наличии в растворе остальных катионов этой же аналитической группы (
Определение серебра проводят из его аммиачного раствора разложением соответствующего аммиаката азотной кислотой по реакции:
Ход анализа. К 5-6 каплям нитрата серебра прибавить равный объем хлорида калия, тщательно перемешать и отфильтровать через бумажный фильтр. Осадок на фильтре промыть раствором гидроксида аммония (2 н.). К полученному раствору добавить азотную кислоту до образования белого осадка хлорида серебра. 2.2.2.Катион А) Определяется по обменной реакции с иодидом калия с образованием желтого осадка иодида свинца:
Ход анализа. К нескольким каплям раствора нитрата свинца добавить раствор иодида калия до выпадения желтого осадка. Б) можно обнаружить по реакции с хроматом калия. Образуется желтый осадок:
Ход анализа. К нескольким каплям раствора нитрата свинца добавить раствор хромата калия до выпадения желтого осадка. 2.2.3.Катион А. Определяется после предварительного осаждения каломели
При взаимодействии белого осадка каломели с гидроксидом аммония образуется темный осадок, состоящий из черной металлической ртути и хлорида амидортути (II) белого цвета. Вместе они образуют темный осадок.
Ход анализа. К нескольким каплям раствора нитрата ртути (I) добавить равный объем хлорида калия, перемешать и отфильтровать через бумажный фильтр. К осадку на фильтре прилить гидроксид аммония (2 н.). Образование темного осадка на фильтре после фильтрации свидетельствует о наличии иона Б. Обнаружить ртуть можно также по образованию амальгамы ртути на медной монете по реакции (4). 2.3. Третья аналитическая группа катионов 2.3.1.Катион Определяется по обменной реакции с серной кислотой или водорастворимыми сульфатами с образованием белого осадка сульфата бария:
Ход анализа. К нескольким каплям хлорида бария добавить раствор серной кислоты или сульфата натрия до образования белого осадка. 2.3.2.Катион Определяется по реакции, аналогичной обнаружению
Однако сульфат кальция более растворим, чем сульфат бария. Для понижения растворимости сульфата кальция добавляют этиловый спирт или ацетон (50 % от объема раствора), что способствует выпадению осадка. К понижению растворимости CaSO4 приводит также нагревание раствора и добавление избытка серной кислоты. 2.4. Четвертая аналитическая группа катионов 2.4.1.Катион А. Определяется по реакции с сероводородом или сульфидом натрия при рН~2 с образованием белого осадка сульфида цинка:
Ход анализа. К нескольким каплям соли цинка добавить сероводородной воды или раствор сульфида натрия до выпадения белого осадка сульфида цинка. Б. Присутствие ионов цинка в отсутствие железа определяют по реакции с гексацианоферратом (II) калия K4[Fe(CN)6] («желтой кровяной солью»). При этом образуется белый осадок двойной соли – гексацианоферрата (II) цинка-калия, растворимый в щелочах:
Эта реакция отличает Zn2+ от Al3+, который с K4[Fe(CN)6] осадка не образует. Ход анализа. К нескольким каплям соли цинка добавить гексацианоферрат (II) калия до выпадения белого осадка. В. В отсутствие солей кобальта, никеля и железа, цинк определяют по реакции с тетрароданомеркуриатом аммония (NH4)2[Hg(CNS)4], приводящей к образованию белого осадка тетрароданомеркуриата цинка:
Примечание. Данную реакцию ведут в слабокислой среде, т.к. осадок Zn[Hg(CNS)4] в сильных кислотах растворим, а под действием щелочей применяемый реагент (NH4)2[Hg(CNS)4] разлагается с образованием желтого осадка HgO. Ход анализа. К нескольким каплям соли цинка добавить тетрароданомеркуриат аммония до выпадения белого осадка. 2.4.2.Катион Растворы солей хрома (III) имеют зеленую окраску. Растворы солей хрома (VI), в щелочных средах представленные хроматами, окрашены в желтый цвет, а в более кислых средах, представленные дихроматами, имеют оранжевую окраску.
А. Определение Cr (III) основано на предварительном его окислении пероксидом водорода в щелочной среде до хроматов:
с последующей его идентификацией по реакции с хлоридом бария (или нитратом свинца (II)), приводящей к образованию желтого осадка хромата бария (свинца):
Ход анализа. К 2-3 каплям раствора соли хрома (III) добавить щелочь до полного растворения образующегося осадка гидроксида хрома (III), а затем 5-7 капель 30 % раствора пероксида водорода и кипятить до исчезновения мелких пузырьков. Желтый цвет полученного раствора свидетельствует о полном окислении хрома (III). К полученному желтому раствору добавить раствор соли бария или свинца до выпадения желтого осадка хромата. При наличии в растворе сульфат-ионов, проверка раствора на наличие в нем ионов хрома может быть осуществлена следующими двумя способами (Б и В): Б. Перевод хромат-ионов в дихромат-ионы в кислой среде по реакции:
Образующийся по реакции дихромат калия имеет оранжевую окраску. В избытке добавляемой кислоты, т.е. в сильнокислых растворах, возможен переход окраски из оранжевой в красную за счет образования полихроматов: Ход анализа. К полученному по реакциям (33) желтому раствору хромата калия добавить по каплям раствор серной кислоты до перехода окраски в оранжевую и красную. В. После образования дихромата по реакциям (33) и (36) в кислой среде его переводят в надхромовую кислоту перекисью водорода в присутствии амилового спирта:
Надхромовая кислота имеет синий цвет. В водных растворах быстро разлагается с образованием зеленого раствора хрома (III), поэтому соответствующую реакцию проводят в присутствии амилового спирта, в котором раствор надхромовой кислоты значительно устойчивее. Ход анализа. К 2-3 каплям полученного по реакциям (33) и (36) раствора дихромата добавить 5-6 капель пероксида водорода (3 %), 2 мл амилового спирта и избыточное количество раствора 20 % серной кислоты. После интенсивного перемешивания верхний слой амилового спирта окрасится в синий цвет. 2.4.3.Катион Характерным и очень чувствительным реактивом обнаружения алюминия является алюминон (ауринтрикарбонат аммония) - сложное органическое соединение, образующее с
Реакция протекает только при pH»5 в среде ацетатного буферного раствора ( Ход анализа. К 2 мл исходного раствора соли алюминия добавить по каплям уксусную кислоту и ацетат натрия в соотношении 1:2. Перемешать и проверить рН. Точно значение рН = 5 устанавливают добавлением уксусной кислоты (при рН>5) или ацетата натрия (при рН<5). Затем добавить 1-2 капли 0,01 % раствора алюминона - образуется красный осадок. Появляющаяся красно-розовая окраска при нагревании усиливается. 2.5. пятая аналитическая группа катионов 2.5.1.Катион Определяется по реакции с гидроортофосфатом натрия при рН»9 в присутствии ионов аммония. Реакция идет с образованием белого кристаллического осадка двойной соли - ортофосфата аммония-магния:
Назначение добавки Ход анализа. К 2 каплям раствора соли магния добавить раствор хлорида аммония, 2 капли гидроортофосфата натрия и гидроксид аммония (2 н.) до рН»9 (по каплям, при перемешивании и измерении рН после добавления каждой капли). Если белый кристаллический осадок не образуется, то необходимо добавить 2.5.2.Катион Определяется окислением до Mn (VII) висмутатом натрия в азотнокислой среде с образованием розового раствора марганцевой кислоты:
Ход анализа. К 2-м каплям раствора соли марганца (II) прибавить 2 мл 6 н. раствора азотной кислоты и немного твердого висмутата натрия (на кончике шпателя). Смесь перемешать. При этом образуется раствор марганцевой кислоты розового цвета. 2.5.3.Катион А. Определяется реакцией комплексообразования с тиоцианатом (роданидом) с образованием кроваво-красного раствора тритиоцианатажелеза (III)
Ход анализа. К нескольким каплям раствора соли железа (III) добавить по каплям раствор тиоцианата аммония или калия до образования кроваво-красного раствора. Б. Другим известным способом определения железа (III) является реакция с гексацианоферратом (II) калия. При этом образуется темно-синий осадок гексацианоферрата (III) железа (II) («берлинская лазурь»):
Ход анализа. К нескольким каплям раствора соли железа (III) добавить по каплям раствор гексацианоферрата (II) калия до образования темно-синего осадка. 2.6. Шестая аналитическая группа катионов 2.6.1.Катион А. Определяется по реакции комплексобразования в избытке гидроксида аммония с образованием ярко-синего раствора, содержащего комплексный катион тетраамминмеди (II). Реакция протекает в две стадии. Сначала образуется зеленый осадок основной соли меди (например, гидроксосульфата)
который растворяется в избытке гидроксида аммония
Ход анализа. К нескольким каплям раствора соли меди добавить по каплям 2 н. раствор гидроксида аммония, наблюдая сначала образование зеленого осадка, а затем его растворение с образованием ярко-синего раствора. Б. Более чувствительным, чем реакция с аммиаком, является обнаружение Cu2+ с гексацианоферратом (II) калия. При рН£7 образуется красно-бурый осадок гексацианоферрата (II) меди:
Осадок не растворим в разбавленных кислотах, но растворяется в аммиаке и разлагается при действии щелочей. 2.6.2.Катион Никель определяется по реакции с диметилглиоксимом в аммиачной среде (рН»8-10), с которым он образует малиновый осадок внутрикомплексной соли - диметилглиоксимата натрия
Диметилглиоксим (реактив Чугаева) является двухдентатным лигандом со структурной формулой:
имеющим два донорных атома азота. Реактив очень чувствителен к иону
Ход анализа. К 2-3 каплям раствора соли никеля добавить 1-2 капли раствора диметилглиоксима и несколько капель разбавленного раствора гидроксида аммония до рН»8-10. 2.6.3. Катион
Ход анализа. К 2-3 каплям раствора соли кобальта (II) добавить 1-2 капли ацетатного буфера (pH»5), избыток тетрароданомеркурата аммония, 1-2 капли раствора сульфата цинка и перемешать. Примечание. Выпадение осадка может происходить через некоторое время после смешивания реактивов. 2.6.4.Катион Определяется по реакции с сероводородом при рН=0,5-0,8 с образованием желтого осадка сульфида кадмия, в разбавленных растворах образуется коллоидный раствор также желтого цвета
Ход анализа. К нескольким каплям соли кадмия добавить сероводородную воду до образования желтого осадка или коллоидного раствора того же цвета. 2.6.5.Катион Способом обнаружения
с образованием медно-ртутной амальгамы (светлое пятно). Ход анализа. Медную пластину предварительно обработать азотной кислотой для удаления пассивирующей пленки оксида меди, промыть водой и протереть фильтровальной бумагой. На подготовленную медную пластину капнуть раствор нитрата ртути (II) и наблюдать образование светлого металлического пятна. 3. Краткие указания по технике выполнения аналитических работ Для усвоения методики кислотно-основного метода систематического анализа и приобретения необходимой лабораторной практики студентам в индивидуальном порядке предлагается выполнение четырех аналитических работ, методические указания, по которым приведены в разделах 3-6. Каждая аналитическая работа выполняется по приведенной схеме анализа и соответствующему ее описанию. Для выполнения анализа отбирается часть (1/3 или 1/2) предложенной задачи, что соответствует ~2/3 пробирки. Другая часть задачи остается в качестве резервной. Любая химическая реакция осуществляется в пробирке при перемешивании стеклянной палочкой. В редких случаях реакцию проводят непосредственно в фильтровальной воронке с бумажным фильтром. В последнем случае перемешивание должно быть особо осторожным, предупреждающим повреждение бумажного фильтра. При необходимости нагрева реакционной смеси или ее кипячения эти операции проводят в пробирках на песчаной бане с использованием специальных держателей. Операции фильтрования проводят на бумажных фильтрах марки «синяя лента». Сбор фильтрата осуществляют в пробирку. При необходимости сбора осадка, его осуществляют переносом осадка с бумажного фильтра в сухую пробирку. В отдельных случаях, главным образом, в операциях разделения отдельных аналитических групп, требуется промывка осадка на фильтре дистиллированной водой. Операцию промывки проводят на фильтре основной операции, но промывные воды собирают в отдельную пробирку и не используют. В операциях разделения отдельных аналитических групп требуется проверка полноты осаждения. Полнота осаждения контролируется путем добавления небольших количеств используемого группового реагента к полученному фильтрату. Если имеет место повторное выпадение осадка, его отфильтровывают на первичном фильтре, содержащем основной осадок, и повторно проверяют полноту осаждения. Операцию повторяют до полного осаждения. Любая качественная аналитическая реакция является «капельной», т.е. для ее выполнения достаточный объем пробы составляет несколько капель (обычно от 2-х до 5-ти). При проведении этих реакций следует использовать указания раздела 2 и сведения таблицы приложения. Во многих случаях при осуществлении реакций требуется контроль рН, который осуществляют с помощью универсального бумажного индикатора. Техника измерения рН предусматривает нанесение капли анализируемого раствора стеклянной палочкой на бумагу-индикатор. Величину рН определяют по цветовой гамме индикатора. |



 или
или  может быть достигнуто восстановлением их металлической медью с образованием медно-ртутной амальгамы (светлое пятно на медной пластине)
может быть достигнуто восстановлением их металлической медью с образованием медно-ртутной амальгамы (светлое пятно на медной пластине) ,
, .
. может быть достигнуто по его реакции с тиоцианатом (роданидом) за счет образования синего раствора тетратиоцианатокобальтат (II) - иона:
может быть достигнуто по его реакции с тиоцианатом (роданидом) за счет образования синего раствора тетратиоцианатокобальтат (II) - иона: .
. , аналогично реагирующий с тиоцианатом с образованием красного раствора тритиоцианата железа (III):
, аналогично реагирующий с тиоцианатом с образованием красного раствора тритиоцианата железа (III): .
. в этом случае невозможно. Мешающее влияние иона
в этом случае невозможно. Мешающее влияние иона  может быть устранено за счет его «маскировки».
может быть устранено за счет его «маскировки». в неактивное состояние в виде фторидных
в неактивное состояние в виде фторидных
 ,
, хлоридом олова (II)
хлоридом олова (II) .
. ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  .
. и
и  . Групповым реагентом является соляная кислота, осаждающая соответствующие катионы в виде малорастворимых хлоридов, например,
. Групповым реагентом является соляная кислота, осаждающая соответствующие катионы в виде малорастворимых хлоридов, например, .
. и
и  . Групповым реагентом является серная кислота, осаждающая соответствующие катионы в виде сульфатов, например:
. Групповым реагентом является серная кислота, осаждающая соответствующие катионы в виде сульфатов, например: .
. ,
, 
 ,
, .
. .
. .
. .
. ,
,  ,
,  , образующие прочные комплексные соединения с аммиаком, растворимые в воде, и по этому признаку группа называется аммиачной. Групповым реагентом является гидроксид аммония, взятый в избытке, достаточном для растворения образующихся вначале гидроксидов с получением аммиакатов, например:
, образующие прочные комплексные соединения с аммиаком, растворимые в воде, и по этому признаку группа называется аммиачной. Групповым реагентом является гидроксид аммония, взятый в избытке, достаточном для растворения образующихся вначале гидроксидов с получением аммиакатов, например: .
. . По этому принципу группа называется хлоридной.
. По этому принципу группа называется хлоридной. . По этому признаку группа называется сульфатной. Сульфат кальция более растворим, чем сульфат бария и для уменьшения его растворимости добавляют при нагревании этиловый спирт или ацетон.
. По этому признаку группа называется сульфатной. Сульфат кальция более растворим, чем сульфат бария и для уменьшения его растворимости добавляют при нагревании этиловый спирт или ацетон. - в водных растворах бесцветен.
- в водных растворах бесцветен. .
. !
! - в водных растворах бесцветен.
- в водных растворах бесцветен. .
.
 - в водных растворах бесцветен.
- в водных растворах бесцветен.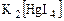 - тетраиодомеркурата (II) калия, образует с растворами аммонийных солей бурый осадок иодида основания Миллона, имеющего химическую формулу
- тетраиодомеркурата (II) калия, образует с растворами аммонийных солей бурый осадок иодида основания Миллона, имеющего химическую формулу  . Это соединение можно рассматривать как продукт замещения иодом гидроксильной группы в гидратированном основании Миллона
. Это соединение можно рассматривать как продукт замещения иодом гидроксильной группы в гидратированном основании Миллона  . Основание Миллона содержит катион
. Основание Миллона содержит катион  , который можно рассматривать как ион
, который можно рассматривать как ион 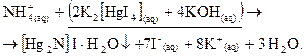
 - в водных растворах бесцветен.
- в водных растворах бесцветен. .
.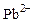 ,
,  ) последние реагируют аналогичным образом с образованием белых осадков хлоридов свинца и ртути. Поэтому для идентификации серебра, его хлорид растворяют в гидроксиде аммония с образованием хлорида диамминсеребра по реакции:
) последние реагируют аналогичным образом с образованием белых осадков хлоридов свинца и ртути. Поэтому для идентификации серебра, его хлорид растворяют в гидроксиде аммония с образованием хлорида диамминсеребра по реакции: .
. .
.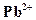 - в водных растворах бесцветен.
- в водных растворах бесцветен. .
.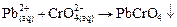 .
. (димер Hg (I)) - в водных растворах бесцветен.
(димер Hg (I)) - в водных растворах бесцветен. :
: .
. темный
темный - в водных растворах бесцветен.
- в водных растворах бесцветен. - в водных растворах бесцветен.
- в водных растворах бесцветен.
 .
. - в водных растворах бесцветен.
- в водных растворах бесцветен. .
. .
. .
.
 - зеленый,
- зеленый,  - желтый,
- желтый,  ‑ оранжевый.
‑ оранжевый.
 или
или
 .
. ,
,  и т.д.
и т.д.
 - в водных растворах бесцветен.
- в водных растворах бесцветен. труднорастворимую соль красного цвета:
труднорастворимую соль красного цвета: .
. - 1:2), т.к. в ходе реакции алюминий замещает однозарядный катион аммония в виде гидроксокомплекса [Al(OH)2]+, существующем при рН = 5. При проведении реакции следует учитывать, что алюминон сам окрашен в красный цвет и его расход на реакцию должен быть очень небольшим.
- 1:2), т.к. в ходе реакции алюминий замещает однозарядный катион аммония в виде гидроксокомплекса [Al(OH)2]+, существующем при рН = 5. При проведении реакции следует учитывать, что алюминон сам окрашен в красный цвет и его расход на реакцию должен быть очень небольшим. - в водных растворах бесцветен.
- в водных растворах бесцветен.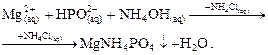
 заключается в увеличении концентрации ионов аммония в растворе для снижения требуемого расхода гидроксида аммония и предотвращения образования осадка гидроксида магния.
заключается в увеличении концентрации ионов аммония в растворе для снижения требуемого расхода гидроксида аммония и предотвращения образования осадка гидроксида магния. - в относительно концентрированных растворах соли имеют бледно-розовый цвет, в разбавленных растворах - бесцветны.
- в относительно концентрированных растворах соли имеют бледно-розовый цвет, в разбавленных растворах - бесцветны. .
. - растворы имеют желтую окраску.
- растворы имеют желтую окраску. .
. .
. - растворы солей окрашены в голубой или зеленый цвет.
- растворы солей окрашены в голубой или зеленый цвет. ,
,
 .
. - растворы солей окрашены в зеленый цвет.
- растворы солей окрашены в зеленый цвет.

 , с которым он образует очень прочное внутрикомплексное соединение (хелат), содержащее пятичленные циклы во внутренней сфере комплекса:
, с которым он образует очень прочное внутрикомплексное соединение (хелат), содержащее пятичленные циклы во внутренней сфере комплекса:
 - растворы солей имеют розовый цвет. Определяется по реакции с тетрароданомеркуратом аммония при рН=5 с образованием синего кристаллического осадка тетрароданомеркурата кобальта (III). Добавление
- растворы солей имеют розовый цвет. Определяется по реакции с тетрароданомеркуратом аммония при рН=5 с образованием синего кристаллического осадка тетрароданомеркурата кобальта (III). Добавление  ускоряет реакцию:
ускоряет реакцию: .
. - в водных растворах бесцветен.
- в водных растворах бесцветен. .
. - в водных растворах бесцветен.
- в водных растворах бесцветен. является восстановление его металлической медью
является восстановление его металлической медью