 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Определение теплоты растворения кристаллогидрата 12
Кристаллогидрат тщательно растирают в ступке в порошок, взвешивают рассчитанное количество и высыпают в чистую сухую пробирку. Воды для растворения кристаллогидрата необходимо взять меньше, учитывая количество воды, которое содержится в нём. mводы= mкристаллогидрата- mбезв. соли= ρ Vводымл Для этого в цилиндр заливают заданное количество воды и пипеткой отбирают количество воды, содержащееся в кристаллогидрате. Воду наливают в калориметр, погружают в неё пробирку с кристаллогидратом и приступают к калориметрическим измерениям. Результаты калориметрических измерений заносят в таблицу Обработка результатов Расчёт постоянной калориметра. На основании полученных данных (табл) построить графики t = f(τ) для определения действительного изменения температуры (Δt) при растворении соли, по которой проводилось измерение постоянной калориметра К. График строят на миллиметровой бумаге, в масштабе 1 мин = 1 см на оси абсцисс откладывают время, на оси ординат - температуру, выбор масштаба которой зависит от величины Δt. При Δt ≤ 1° C, 1° = 10 см; при Δt ≥ 1° C, 1° = 5 см.
Рис. 2. Графическое определение изменения температуры в ходе калориметрического опыта при измерении экзотермического эффекта: (τ1- τ2) - предварительный период; (τ2- τ3) - главный период; (τ3- τ4) - заключительный период. Вычисление Δt. При определении Δt необходимо учитывать, что в процессе опыта калориметр непрерывно обменивается теплом с окружающей средой, то есть получает или отдает некоторое количество тепла. Наиболее простой способ учета теплообмена - графический. После нанесения на график всех экспериментальных точек получается кривая ABCD (рис. 2). Участок AB называется предварительным периодом, BC - главным, CD - заключительным. Экстраполируют зависимость температуры от времени предварительного и заключительного периодов на время главного периода (линии AF и GD). На ось ординат наносят точки b и c, соответствующие начальной и конечной температурам главного периода. Через середину отрезка bc проводят линию Pp, пересечение которой с линией ABCD дает точку L. Через эту точку проводят вертикальную прямую до пересечения с прямыми AF и GD. Отрезок fg и будет равен Δt. Характер линии BC зависит от условий протекания теплового процесса (например, от размешивания), наклон кривых AB и CD зависит от характера теплообмена с окружающей средой. Таким образом, по виду кривой ABCD можно судить о качестве проведенного опыта. Определив Δt, необходимо рассчитать постоянную калориметра К:
где: Qp.- тепловой эффект растворения 1 моля соли, mc- масса соли, Мс- молярная масса соли, Δt - изменение температуры. Расчёт теплоты растворения безводной соли и её кристаллогидрата Аналогично, как было показано выше, построить графики для определения Δt при растворении безводной соли и её кристаллогидрата. Рассчитать теплоты растворения безводной соли и её кристаллогидрата по уравнению (1.5) для данного разбавления раствора:
где: Qp.- тепловой эффект растворения 1 моля соли, mc- масса соли, Мс- молярная масса соли, Δt - изменение температуры. Расчёт теплоты гидратации Теплоту образования Q кристаллогидрата из безводной соли вычисляют по уравнению: Q = Qбезв- Qкрист(1.6) Отчёт о работе 1. Построить графики, заполнить таблицы , выполнить необходимые расчеты для определения постоянной калориметра, теплоты растворения безводной соли и её кристаллогидрата. 2. Привести термохимическую схему, иллюстрирующую расчёт теплоты гидратации по закону Гесса. 3. Рассчитать теплоту гидратации. 4. Используя справочные данные по теплотам гидратации (сольватации) рассчитать погрешность эксперимента. Проанализировать причины погрешности. 5. Сделать вывод по работе. 6. Ответить на контрольные вопросы, решить задачи. Примерные контрольные вопросы 1. Дать определение понятий: "термодинамическая система", "открытая система", "закрытая система", "изолированная система". Привести примеры. 2. Дать определение понятия "процесс" ? Дать определение изотермических, адиабатических, изобарических и изохорических процессов. Графическое изображение процессов. 3. Дать определение понятий: работа, теплота, внутренняя энергия. Каковы общие черты теплоты и работы ? Их отличия ? 4. Что такое функция состояния ? Привести примеры. 5. Содержание и формулировка 1-го начала термодинамики. 6. Первый закон термодинамики для различных процессов. Вывести математические выражения для теплоты и работы следующих процессов: изохорного, изобарного, изотермического, адиабатического. 7. Что такое энтальпия, её физический смысл. 8. Тепловой эффект реакции. Соотношение между теплотами реакций при постоянном давлении и при постоянном объеме. 9. Закон Гесса, следствия из него (на примерах реакций). 10. Термодинамическая и термохимическая системы знаков для тепловых эффектов реакций. 11. Теплота образования, стандартная теплота образования. Расчет теплового эффекта по теплотам образования. Пример. 12. Теплота сгорания, стандартная теплота сгорания. Расчет теплового эффекта по теплотам сгорания. Пример. 13. Зависимость теплоты реакции от температуры. Уравнение Кирхгоффа и его решение. 14. В чем заключается калориметрический метод измерения теплоты гидратации соли ? 15. Физический смысл постоянной калориметра. 16. Рассмотреть термохимическую схему расчета теплоты гидратации медного купороса на основе закона Гесса. 17. Теплота растворения. Почему процессы растворения веществ могут протекать не только с экзотермическим, но и с эндотермическим эффектом.
12 |




 (1.4)
(1.4)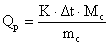 (1.5)
(1.5)
