 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Гидролиз по аниону (соль образована слабой кислотой и сильным основанием.
Лабораторная работа № 16 «Гидролиз солей» Теоретическая часть Обменная реакция между водой и химическим соединением называется его гидролизом. В результате протекания процесса гидролиза соли в растворе появляется некоторое избыточное количество ионов Гидролиз солей можно упрощенно представить следующими схемами:
где Гидролиз приводит к образованию малодиссоциирующих кислот, оснований, кислых или основных солей. Тип реакции гидролиза зависит, прежде всего, от химической природы катионов и анионов, образующих соли, и их поляризующего действия на молекулы воды, зависящего от заряда и радиуса ионов. Чем больше заряд и меньше радиус ионов соли, тем сильнее их электростатическое и поляризационное взаимодействие с водой, слабее диссоциация образующихся частиц Влияние на молекулы воды невелико у катионов щелочных и щелочноземельных металлов, однозарядных анионов, например Гидролизу подвергается не вся соль в растворе. Отношение числа гидролизованных молекул соли к общему числу растворенных молекул называется степенью гидролиза h:
где Процесс гидролиза является обратимым. В растворе соли, подвергшейся гидролизу, устанавливается равновесие между солью и продуктами гидролиза:
Этому равновесию соответствует константа
Так как концентрация воды в разбавленных растворах солей является практически постоянной величиной, то
Значение В величине
На состояние равновесия между солью и продуктами гидролиза Реакция гидролиза протекает с поглощением теплоты (эндотермическая реакция). Поэтому при повышении температуры по принципу Ле Шателье равновесие реакции гидролиза также смещается в сторону образования продуктов гидролиза, т. е. степень гидролиза соли увеличивается. Итак, для уменьшения степени гидролиза растворы солей следует хранить концентрированными и при низких температурах. Возможны следующие случаи гидролиза солей: гидролиз по аниону, по катиону, по катиону и аниону одновременно. Гидролиз по аниону. Ему подвергаются соли, образованные катионом сильного основания и анионом слабой кислоты (K2CO3, Na2S, Na2SO3, K3PO4 и др.). При гидролизе создается щелочная среда (рН > 7). Например:
Молекулярное уравнение гидролиза –
Как видно, гидролизу подвергается анион слабой кислоты Гидролиз многозарядного аниона протекает ступенчато в связи со ступенчатой диссоциацией многоосновных кислот, при обычных условиях главным образом по первой ступени. Например:
Молекулярные уравнения соответственно имеют вид
Молекулярное уравнение гидролиза –
Согласно уравнению гидролизу подвергается катион слабого основания Гидролиз многозарядного катиона протекает ступенчато, при обычных условиях главным образом по первой ступени. Например:
Молекулярное уравнение 1-й ступени гидролиза −
Уравнение гидролиза образовавшейся основной соли сульфата гидроксомеди (вторая ступень гидролиза)
Молекулярное уравнение 2-й ступени гидролиза −
Образующиеся при гидролизе по первой ступени ионы Гидролиз по катиону и аниону. По катиону и аниону гидролизуются соли, образованные катионом слабого основания и анионом слабой кислоты, например ацетат алюминия Al(CH3COO)3. Гидролиз соли протекает ступенчато до образования основных солей – ацетатов гидроксо- и дигидроксоалюминия. Уравнения гидролиза ацетата алюминия −
Молекулярные уравнения −
При гидролизе катиона Реакция растворов солей, образованных слабой кислотой и слабым основанием, зависит от соотношения констант диссоциации кислоты и основания, образующих соль. Если константа диссоциации кислоты больше константы диссоциации основания, то раствор имеет слабокислую реакцию, при обратном соотношении констант диссоциации – слабощелочную. Если кислота и основание, образующие соль, не только слабые электролиты, но и неустойчивые, разлагаются с образованием летучих продуктов, то гидролиз соли может протекать необратимо, т. е. соль подвергается полному гидролизу. Например, при взаимодействии в растворе сульфата алюминия с карбонатом натрия выпадает осадок гидроксида алюминия и выделяется диоксид углерода:
в ионно-молекулярной форме – соответственно
Экспериментальная часть Цель работы: изучить поведение солей в водных растворах и научиться определять характер среды, т. е. рН раствора, а также изучить факторы, влияющие на степень гидролиза. Приборы и реактивы. Штативы с пробирками, спиртовки, индикаторы (универсальный индикатор со стандартной шкалой рН), 0,5н растворы солей: карбоната натрия, сульфата алюминия, хлорида натрия, хлорида олова, соляная кислота, едкий натр. Опыт № 1 Гидролиз по аниону (соль образована слабой кислотой и сильным основанием. На полоску универсального индикатора нанести каплю раствора карбоната натрия. Полученную окраску индикатора сравнить со стандартной шкалой рН. Определить рН раствора этой соли. Написать уравнения гидролиза соли карбоната натрия в молекулярной и ионно-молекулярной формах. Опыт № 2 |



 или
или  , сообщающее раствору кислую или основную среду. Таким образом, процесс гидролиза соли обратен процессу нейтрализации, т. е. процессу взаимодействия кислот с основаниями.
, сообщающее раствору кислую или основную среду. Таким образом, процесс гидролиза соли обратен процессу нейтрализации, т. е. процессу взаимодействия кислот с основаниями.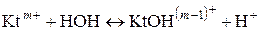

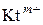 – катион,
– катион,  – анион.
– анион. ) и
) и  и в большей степени происходит гидролиз.
и в большей степени происходит гидролиз. ,
,  ,
,  , у некоторых двухзарядных, например
, у некоторых двухзарядных, например  , т.е. соли, образованные анионом сильной кислоты и катионом сильного основания, гидролизу не подвергаются, например KCl, NaNO3.
, т.е. соли, образованные анионом сильной кислоты и катионом сильного основания, гидролизу не подвергаются, например KCl, NaNO3.
 – концентрация гидролизованной части соли;
– концентрация гидролизованной части соли;  – общая концентрация растворенной соли.
– общая концентрация растворенной соли.

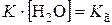 , где величина
, где величина  называется константой гидролиза соли:
называется константой гидролиза соли:
 определяет способность данной соли подвергаться гидролизу: чем больше
определяет способность данной соли подвергаться гидролизу: чем больше  (константой диссоциации основания
(константой диссоциации основания  ) зависимостью
) зависимостью

 влияет концентрация каждого из участвующих в реакции веществ и температура. При уменьшении концентрации соли путем разбавления раствора увеличивается относительная концентрация молекул воды, и по принципу Ле Шателье равновесие реакции гидролиза смещается в сторону образования продуктов гидролиза, т. е. степень гидролиза соли увеличивается.
влияет концентрация каждого из участвующих в реакции веществ и температура. При уменьшении концентрации соли путем разбавления раствора увеличивается относительная концентрация молекул воды, и по принципу Ле Шателье равновесие реакции гидролиза смещается в сторону образования продуктов гидролиза, т. е. степень гидролиза соли увеличивается.
 реакция не идет;
реакция не идет;

 , входящий в состав соли, и реакция сопровождается образованием малодиссоциированных молекул уксусной кислоты CH3COOH и ионов
, входящий в состав соли, и реакция сопровождается образованием малодиссоциированных молекул уксусной кислоты CH3COOH и ионов 
 (1-я ступень);
(1-я ступень); (2-я ступень).
(2-я ступень).

 Гидролиз по катиону. Ему подвергаются соли, образованные катионом слабого основания и анионом сильной кислоты (NH4Br, ZnCl2, Cu(NO3)2 и др.). Среда при гидролизе – кислая (рН < 7). Например:
Гидролиз по катиону. Ему подвергаются соли, образованные катионом слабого основания и анионом сильной кислоты (NH4Br, ZnCl2, Cu(NO3)2 и др.). Среда при гидролизе – кислая (рН < 7). Например:

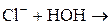 реакция не идет.
реакция не идет.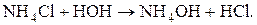
 , входящий в состав соли, и реакция сопровождается образованием малодиссоциированных молекул гидроксида аммония NH4OH и ионов
, входящий в состав соли, и реакция сопровождается образованием малодиссоциированных молекул гидроксида аммония NH4OH и ионов 
 (1-я ступень гидролиза),
(1-я ступень гидролиза), реакция не идет.
реакция не идет.
 (2-я ступень гидролиза)
(2-я ступень гидролиза)
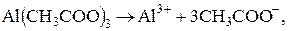




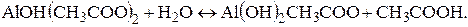
 образуются ионы
образуются ионы  − ионы
− ионы  , образуя молекулы воды, что приводит к смещению обоих равновесий вправо, и гидролиз усиливается.
, образуя молекулы воды, что приводит к смещению обоих равновесий вправо, и гидролиз усиливается.
