 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Определение степени и константы гидролиза соли
Общие положения Гидролиз является разновидностью ионных реакций и представляет собой обменное взаимодействие некоторых солей с водой. Реакция гидролиза имеет место лишь в тех случаях, когда ионы, образующиеся при диссоциации соли, способны образовывать с ионами – продуктами ионизации воды (Н+, ОН-) нерастворимые, газообразные или малодиссоциированые соединения (молекулы или сложные ионы). Гидролизу подвергаются соли трёх видов. Это соли образованные: 1) слабой кислотой и сильным основанием; 2) слабым основанием и сильной кислотой; 3) слабой кислотой и слабым основанием. В обычных условиях гидролизу не подвергаются соли, образованные сильным основанием и сильной кислотой. Следует обратить внимание на то, что гидролиз солей первого и второго из указанных видов протекает обратимо. После выравнивания скоростей прямого и обратного процессов (гидролиза и реакции нейтрализации), устанавливается химическое равновесие. Поэтому при написании уравнений гидролиза этих солей следует использовать символ ↔. Гидролиз солей третьей группы в определённых условиях может протекать практически необратимо и в этом случае в уравнениях реакции следует изображать знак равенства ( = ) или одну стрелку (→). Способы усиления и подавления гидролиза Для усиления или подавления гидролиза можно использовать химические и физические способы. Химические способы основаны на изменении концентраций веществ, находящихся в равновесии. Если в раствор гидролизующейся соли ввести реагент, связывающий образующиеся при гидролизе ионы H+ и ОН-, то, в соответствии с принципом Ле Шателье, равновесие смещается в сторону усиления гидролиза; в результате гидролиз может протекать полностью до образования его конечных продуктов. Аналогичное действие оказывает добавление в раствор воды -разбавление наиболее простой способ усиления гидролиза. Физическим способом равновесие при гидролизе может быть смещено путём изменения температуры. Обратный гидролизу процесс – реакция нейтрализации – протекает с выделением теплоты, а гидролиз представляет собой эндотермический процесс. Поэтому повышение температуры ведет к усилению гидролиза, а понижение – к ослаблению. Количественно реакция гидролиза характеризуется степенью гидролиза α и константой гидролиза Кг. Степень гидролиза α представляет отношение концентрации гидролизованных молекул Сг к общей концентрации вещества С:
Степень гидролиза, как правило, невелика. Причина этого заключается в том, что вода является очень слабым электролитом, поэтому равновесие в процессе гидролиза сильно смещено в сторону исходных веществ. К реакциям гидролиза солей применимы все положения и законы учения о химическом равновесии. К гидролизу, как к равновесному процессу, можно применить закон действующих масс. Например, в случае реакции гидролиза цианида натрия:
или в ионной форме:
Константа равновесия Kр для процесса гидролиза запишется в виде выражения:
или, принимая во внимание, что концентрация воды практически остается постоянной величиной,
Степень гидролиза зависит от температуры и концентрации веществ. Повышение температуры раствора соли во всех случаях приводит к усилению гидролиза, так как нагревание увеличивает степень диссоциации воды. Разбавление растворов также смещает равновесие в сторону образования продуктов гидролиза. Постоянную величину Связь между константой и степенью гидролиза в растворе заданной концентрации (С) выражается законом разбавления Оствальда:
В том случае, если величина α много меньше единицы, ею в знаменателе можно пренебречь, тогда при вычислении можно пользоваться приближенным выражением:
Отсюда: Выражение константы гидролиза (3) можно упростить, если умножить числитель и знаменатель выражения на концентрацию ионов водорода [H+] и на концентрацию кислоты [HCN], тогда получим следующее выражение:
где
Таким образом, константа и степень гидролиза могут быть рассчитаны на основе ионного произведения воды и константы диссоциации, образующихся в результате гидролиза слабого основания или слабой кислоты. Cтепень гидролиза для соли, образованной сильным основанием и слабой кислотой, рассчитывается согласно (6) по уравнению
По аналогии для гидролиза соли слабого основания и сильной кислоты (например, NH4Cl) константа и степень гидролиза рассчитываются по следующим уравнениям:
где Cтепень и константа гидролиза для соли, образованной слабым основанием и слабой кислотой, рассчитываются:
Таким образом, зная константы диссоциации слабых электролитов (кислоты или основания) и ионное произведение воды, можно рассчитать константы гидролиза соответствующих солей. При гидролизе по катиону концентрация гидролизованных молекул Сг равна концентрации ионов водорода H+ . Поэтому для расчета степени и константы гидролиза могут быть применены следующие уравнения:
При гидролизе по аниону концентрация гидролизованных молекул
поэтому степень и константа гидролиза рассчитываются по уравнениям:
Использование вышеприведенных соотношений дает возможность рассчитать и степень гидролиза, и рН раствора соли. Термодинамические характеристики процесса гидролиза – изменение энергии Гиббса, энтальпии, энтропии находят по следующим формулам:
где Порядок выполнения работы 1. Измерить водородный показатель рН дистиллированной воды на приборе рН–метр. Порядок работы на рН–метре приведен в Приложении 1. 2. Из 0,4 М раствора соли приготовить путем последовательного разбавления 0,2; 0,1; 0,05 и 0,025 М раствор соли – по 50 мл каждого раствора. 3. Измерить рН растворов всех пяти концентраций при комнатной температуре. Затем, после выдержки стаканчиков с растворами в термостате или водяной бане в течение 20…30 минут (до достижения нужной температуры,), измерить рН при 50°С и 70°С. 6. Рассчитать степень и константу гидролиза для растворов соли пяти концентраций и трех температур. Расчетные данные занести в таблицу 1. 7. Построить график зависимости степени гидролиза соли α от степени разбавления: α = f(1/С) для трех температур. 8. Рассчитать термодинамические характеристики гидролиза. Результаты расчетов занести в таблицу 2. 9. Сделать вывод о зависимости - степени гидролиза соли от степени разбавления раствора, - степени гидролиза от температуры, - изменения изобарно-изотермического потенциала от температуры. Оценить вклад энтальпийного и энтропийного факторов в изменение изобарно-изотермического потенциала процесса гидролиза. 10. Ответить на дополнительные вопросы: 10.1. Как влияет добавление растворов КОН, ZnCl2, Na2S, соляной кислоты и твердого NaCl на гидролиз карбоната калия? 10.2. Напишите в молекулярном и ионном виде уравнения совместного гидролиза: сульфата хрома (III) и карбоната натрия; нитрата алюминия и сульфида калия. 10.3. Используя справочные данные, рассчитайте степень гидролиза СН3СООК в 0,1 М растворе. Таблица 1 Определение степени и константы гидролиза соли
Таблица 2 Термодинамические характеристики процесса гидролиза соли
Контрольные вопросы 1. Что называется гидролизом соли? Какие вещества образуются в результате гидролиза? 2. Какие соли подвергаются гидролизу? Чем это объясняется? 3. Почему соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются? 4. Какова реакция среды в водных растворах солей, образованных: а) слабым основанием и сильной кислотой; б) сильным основанием и слабой кислотой; в) слабым основанием и слабой кислотой? Список рекомендуемой литературы 1. Ахметов, Н.С. Лабораторные и семинарские занятия по неорганической химии : учеб. пособие для хим.-техн. спец. вузов / Н.С. Ахметов, М.И. Азизова, Л.И. Бадыгина. – М. : Высшая школа, 1979. – 254 с. 2. Васильева, З.Г. Лабораторные работы по общей и неорганической химии : учеб. пособие для студентов нехимич. вузов / З.Г. Васильева, А.А. Грановская, А.А. Таперова. – 2-е изд., испр. – Л. : Химия, Ленинградское отделение, 1986. – 286 с. 3. Глинка, Н.Л. Общая химия / Н.Л.Глинка – М: ИНТЕГРАЛ-ПРЕСС, 2003. – 727 с. 4. Коровин, Н.В. Лабораторные работы по химии : учеб. пособие для технич. направл. и спец. вузов / Н.В. Коровин, Э.И. Мингулина, Н.Г.Рыжова ; под. ред. Н.В. Коровина. – 2-е изд., перераб. и доп. – М. : Высшая школа, 1998. – 256 с. 5. Практикум по общей и неорганической химии : учеб. пособие для студентов вузов / В.И. Фролов, Т.М. Курохтина, З.Н. Дымова [и др.] ; под ред. Н.Н. Павлова, В.И. Фролова. – 2-е изд., перераб. и доп. – М. : Дрофа, 2002. – 301 с.
Приложение 1 Измерение рН с помощью приборов В настоящее время основным методом измерения рН является использование специального прибора – рН-метра.
Таким образом, рН–метр представляет собою милливольтметр. Особенностью такого милливольтметра является очень маленький входной ток, так что он может измерять напряжение с самых разных электродов, в том числе стеклянных, через который большой ток не проходит. Кроме того, у рН-метра имеется система пересчета напряжения в рН (а в более совершенных моделях и в некоторые другие величины). |



 (1)
(1)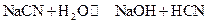


 (2)
(2) (3)
(3) называют константой гидролиза Kг. Она не зависит от концентрации ионов в растворе, но зависит от температуры и природы веществ раствора.
называют константой гидролиза Kг. Она не зависит от концентрации ионов в растворе, но зависит от температуры и природы веществ раствора. (4)
(4) (5)
(5) (6)
(6)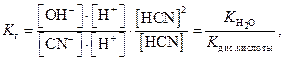 (7)
(7) – ионное произведение воды, равное
– ионное произведение воды, равное  ;
; – константа диссоциации кислоты, равная
– константа диссоциации кислоты, равная
 (9)
(9) (10)
(10) – константа диссоциации основания.
– константа диссоциации основания. (11)
(11)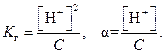 (12)
(12)
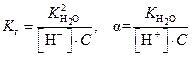 (13)
(13)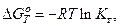 (14)
(14) (15)
(15) (16)
(16) и
и  – константы гидролиза, определенные при температурах Т1 и Т2.
– константы гидролиза, определенные при температурах Т1 и Т2. Рис. 2. Используемый в работе pH–метр.
Рис. 2. Используемый в работе pH–метр.