 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Буферные системы крови - фосфатная
Условия образования и растворения.. Труднорастворимый электролит может оставаться в растворе, пока произведение концентрации его ионов не превышает1 произведения растворимости. Другими словами, если произведение концентраций ионов меньше значения ПР малорастворимого электролита или равно ему, то в этих условиях осадок не образуется. Осадок образуется лишь в тех случаях, когда произведение концентрации ионов становится больше величины ПР. Это возможно при добавлении к раствору, содержащему малорастворимый электролит, хорошо растворимого электролита с одноименным ионом. Увеличение концентрации одного из ионов приводит к смещению динамического равновесия между раствором и твердой фазой в сторону образования осадка. Осадок выпадает до тех пор, пока величина произведения концентрации ионов в растворе не сравняется с величиной произведения растворимости. [1] Если труднорастворимый электролит диссоциирует с образованием нескольких одинаковых ионов, то концентрация каждого из ионов при вычислении произведения растворимости должна быть возведена в соответствующую степень. [3] Растворимость труднорастворимых электролитов понижается в присутствии других сильных электролитов, имеющих одноименные ионы. Осадок труднорастворимого электролита образуется тогда, когда ионное произведение его станет больше произведения растворимости. На этом основании добавляют избыток осадителя для достижения полноты осаждения. [5] Растворимость труднорастворимых электролитов увеличивается в присутствии ионов или молекул веществ, образующих с ионами труднорастворимого электролита растворимые соединения или комплексы. [6] Растворимость труднорастворимого электролита, склонного образовывать недиссоциированные молекулы в присутствии хорошо растворимых электролитов, также образующих недиссоциированные молекулы, оценивается путем решения системы уравнений, состоящих из уравнений баланса ионов. [7] Растворимость труднорастворимого электролита и концентрация образующих его ионов в насыщенном растворе может быть вычислена по величине его произведения растворимости. Методика соответствующих расчетов зависит от характера труднорастворимого электролита, а именно, является ли он солью сильной кислоты и сильного основания или же один из этих компонентов является слабым. [8] Растворимость труднорастворимого электролита и концентрация образующих его ионов в насыщенном растворе может быть вычислена по величине его произведения растворимости. Методика соответствующих расчетов зависит от характера труднорастворимого электролита, а именно, является ли он солью сильной кислоты и сильного основания ли же один из этих компонентов является слабым. [9] Так как труднорастворимые электролиты, используемые в аналитической практике, очень мало растворимы, то насыщенные растворы этих электролитов имеют чрезвычайно малую концентрацию. [10] Насыщенные растворы труднорастворимых электролитов, используемые в аналитической практике, имеют чрезвычайно малую концентрацию. [11] В растворе труднорастворимого электролита произведение концентраций ионов электролита характеризует его способность к растворению или к образованию осадка. [12] Гетерогенные равновесия в водных растворах характеризуются тем, что перенос частиц происходит через поверхность раздела по крайней мере двух сосуществующих фаз. По своему характеру двухфазные гетерогенные равновесия достаточно многообразны, но здесь будут затронуты лишь некоторые из них, представляющие наибольший практический интерес и имеющие важное значение в аналитической, физической химии и в различных химических технологиях. с помощью каких реакций происходит образование гидроксид-фосфата кальция Ca10(PO4)6(OH)2 в костной ткани. 3Ca3(PO4)2 + Ca(OH)2 = 2Ca5(PO4)3OH Буферные системы В процессе жизнедеятельности в организм поступают извне, а также образуются в результате метаболизма продукты, имеющие как кислый, так и основной характер, однако в норме они не изменяют рН внутренней среды благодаря защитным механизмам, регулирующим кислотно-основное равновесие. Различают физиологические и физико-химические механизмы регуляции кислотного-основного равновесия в организме. В основе физиологических механизмов регуляции кислотно-основного равновесия лежат процессы метаболизма, дыхания и мочевыделения, которые изучаются в курсах биохимии, нормальной физиологии, патологической физиологии. В основе физико-химических механизмов лежит поддержание постоянства рН внутренней среды буферными системами организма, которые представлены буферными системами крови, клеток и внеклеточных пространств тканей. Буферные растворы — это растворы, величина рН которых мало изменяется при добавлении к ним небольших количеств сильных кислот или щелочей, а также при разбавлении. C точки зрения протонной теории простейший буферный раствор состоит из слабой кислоты и сопряженного ей основания или слабого основания и его сопряженной кислоты. В этом случае буферное действие растворов характеризуется наличием кислотно-основного равновесия: НА ⇄ Н+ + А– слабая сопряженное кислота основание
В + Н+ ⇄ ВН+ слабое сопряженная основание кислота
Образуемые сопряженные кислотно-основные пары НА/А– и В/ВН+ называют буферными системами. Классификация буферных систем 1. Кислотные. Состоят из слабой кислоты и соли этой кислоты. Например, ацетатная буферная система (CH3COOH+ СН3СООNa ), гидрокарбонатная буферная система (H2CO3 +NaHCO3 ). 2. Основные. Состоят из слабого основания и его соли. Например, аммиачная буферная система (NH3×H2O + NH4Cl). 3. Солевые. Состоят из кислой и средней соли или двух кислых солей. Например, карбонатная буферная система (NaHCO3+Na2CO3 ), фосфатная буферная система (КН2PO4 + К2НPO4). 4. Аминокислотные и белковые. Если суммарный заряд молекулы аминокислоты или белка равен нулю (изоэлектрическое состояние), то растворы этих соединений не являются буферными. Их буферное действие начинает проявляться тогда, когда к ним добавляют некоторое количество кислоты или щелочи. Тогда часть белка (аминокислоты) переходит из изоэлектрического состояния в форму “белок-кислота” или соответственно в форму “белок-основание”. Образуется смесь двух форм белка: а) слабая “белок-кислота” + соль этой слабой кислоты; б) слабое “белок- основание” + соль этого слабого основания:
где R - макромолекулярный остаток белка. Механизм действия буферных систем:
1. Разбавление. При разбавлении водой происходит уменьшение концентрации обоих компонентов в буферной системе в одинаковой степени, поэтому величина их соотношения не изменится. рК(кислоты) и рК(основания) являются постоянными при данной температуре и не зависят от разбавления. Действительно, одновременное понижение концентраций кислоты и соли в ацетатной буферной системе от 0,1М до 0,001М при разбавлении водой изменяет рН буферного раствора с 4,63 до 4,73 (это ничтожное изменение рН при разбавлении буферного раствора в 100 раз обусловлено некоторым изменением коэффициента активности соли). Следовательно, разбавление в конечном итоге мало изменяет рН буферных систем. 2. Добавление кислот и оснований. При добавлении небольших количеств сильных кислот или оснований рН буферных систем изменяется незначительно. Например, рассмотрим ацетатный буфер: СН3СООН / СН3СОО– кислотный компонент – основной компонент– слабая кислота сопряженное основание
а) При добавлении к ацетатному буферу небольшого количества HCl, происходит взаимодействие ионов Н+ с основным компонентом буферного раствора: Н+ + СН3СОО– ⇄ СН3СООН. Степень диссоциации СН3СООН мала и концентрация [H+] практически не меняется. рН буферного раствора уменьшится, но незначительно. Таким образом, если к ацетатному буферу добавить Х моль/л HCl, то уравнение для расчета рН буферной системы принимает вид: рН = рК(кислоты) + lg б) При добавлении небольшого количества NaOH,
В результате этого, добавленное сильное основание заменяется эквивалентным количеством слабого сопряженного основания (СН3СОО–), которое в меньшей степени влияет на реакцию cреды. рН буферного раствора увеличивается, но незначительно. Таким образом, если к ацетатному буферу добавить У моль/л NaOH, то уравнение для расчета рН буферной системы принимает вид: рН = рК(кислоты) + lg
Расчет PH буферных систем Расчет рН буферных систем Для расчета рН в буферном растворе на примере ацетатного буфера рассмотрим процессы, в нем протекающие, и их влияние друг на друга. Ацетат натрия практически полностью диссоциирует на ионы, ацетат-ион подвергается гидролизу, как ион слабой кислоты: CH3COONa ® Na+ + CH3COO– CH3COO– + HOH ⇄ CH3COOH + OH– Уксусная кислота, также входящая в буфер, диссоциирует лишь в незначительной степени: CH3COOН ⇄ CH3COO– + H+ Слабая диссоциация СН3СООН еще более подавляется в присутствии СН3СООNa, поэтому концентрацию недиссоциированной уксусной кислоты принимаем практически равной ее начальной концентрации: [СН3СООН] = [кислота] С другой стороны, гидролиз соли также подавлен наличием в растворе кислоты. Поэтому можно считать, что концентрация ацетат-ионов в буферной смеси практически равна исходной концентрации соли без учета концентрации ацетат-ионов, образующихся в результате диссоциации кислоты: [СН3СОО–] = [соль] Согласно закону действующих масс, равновесие между продуктами диссоциации уксусной кислоты и недиссоциированными молекулами подчиняется уравнению: Кд = Подставив общую концентрацию кислоты и соли в уравнение константы диссоциации, получим: [Н+] = Кд отсюда для кислотных буферных систем: рН = рК(кислоты) + lg
После аналогичного вывода для основных буферных систем: рОН = рК(основания) + lg где рК(кислоты), рК(основания) - отрицательный десятичный логарифм константы электролитической диссоциации слабой кислоты; слабого основания; [соль] - концентрация соли, [кислота] - концентрация кислоты, [основание] - концентрация основания. Из этих уравнений видно, что рН кислотной (основной) буферной системы зависит от природы слабого электролита (рК(кислоты), рК(основания)) и от соотношения концентраций соли и кислоты (основания). Следует отметить, что буферные системы эффективно поддерживают рН в диапазоне: рК(кислоты) ± 1 для кислотных систем; 14 – (рК(основания) ± 1) для основных систем. Буферные системы крови. Наиболее важным буфером организма является гидрокарбонатная буферная система, обеспечивающая около 55% буферной емкости крови. Более того, эта система занимает центральное положение среди всех других важных механизмов гомеостаза ионов водорода, включая гемоглобиновую буферную систему (которая обеспечивает 35% буферной емкости крови), а также секрецию ионов водорода в почках. Непосредственно измерить очень низкую концентрацию угольной кислоты в крови практически невозможно. При равновесии с растворенным СО2 в уравнение вместо [Н2СО3] вводят [СО2]. Уравнение Гендерсона – Гассельбаха принимает следующий вид: рН = 6,1 + lg Практически в крови измеряют парциальное давление углекислого газа СО2. Концентрацию растворенного в плазме СО2 рассчитывают, умножая Поэтому, если рН = 6,1 + lg Парциальное давление СО2 в плазме крови в норме составляет ~ 5,3 кПа (40 мм.рт.ст.), что соответствует концентрации СО2~ 1,2 ммоль/л. Поддержание постоянства этого уровня зависит от равновесия между высвобождением СО2 в результате реакций обмена веществ и его потерями из организма через альвеолы. В клетках почечных канальцев и в эритроцитах часть СО2 задержанная легкими, используется для образования гидрокарбонат-ионов. Почки играют ведущую роль в поддержании постоянства концентрации бикарбонатов в циркулирующей крови. Эритроциты осуществляют тонкую регуляцию бикарбонатов в плазме крови. При рН = 6,1 + lg Таким образом, активная реакция плазмы артериальной крови у здоровых людей соответствует рН= 7,40. Снижение соотношения [НС Повышение соотношения [НС Так как в плазме крови основную роль в связывании ионов Н+ играет гидрокарбонат – анион, его концентрация в плазме обусловливает резервную щелочность крови. Гемоглобиновая буферная система находится только в эритроцитах. Механизм ее действия связан с присоединением и отдачей кислорода. В связи с этим гемоглобин (Нв) имеет окисленную ННвО2 и восстановленную ННв формы. ННв + О2 ⇄ ННвО2⇄ Н+ + кислота сопряженное основание ННв ⇄ Н+ + Нв– кислота сопряженное основание
Механизм действия основан на реакциях:
основание ННвО2 + ОН– ⇄ кислота ННв + ОН– ⇄ Нв– + Н2О кислота Нв– + Н+®ННв основание Из представленных выше схематических реакций видно, что добавление сильной кислоты или сильной щелочи вызвает защитную реакцию буферной системы по сохранению постоянного значения рН среды, что объясняется связыванием добавляемых Н+ и ОН– и образованием малодиссоциирующих электролитов. Гемоглобиновая буферная система в организме эффективно функционирует только в сочетании с гидрокарбонатной системой. буферные системы крови - фосфатная Фосфатная буферная система содержится как в крови, так и в клеточной жидкости других тканей, особенно в почках. В клетках она представлена КН2РО4 и К2НРО4. В плазме крови и межклеточном пространстве NaH2PO4 и Na2HPO4. Основную роль в механизме действия этой системы играет ион
кислота сопр.основание
Увеличение концентрации Н+ приводит к сдвигу реакции влево, т.е. к образованию кислоты: основание сопр. кислота
Белковые буферные системы являются амфолитными, т.к. в их состав входят a – аминокислоты, содержащие группы с кислотными свойствами (–СООН и – кислотная буферная система а) H3N+ – R – COOH + OH– ⇄H3N+ – R – COO– + H2O белок–кислота б) H3N+ – R – COO– + H+ ⇄H3N+ – R – COOН соль белка–кислоты (сопряженное основание) основная буферная система а) H2N – R – COO– + Н+ ⇄H3N+ – R – COO– белок–основание б) H3N+ – R – COO– + ОН– ⇄H2N – R – COO– + Н2О соль белка–основания (сопряженная кислота) где R – макромолекулярный остаток белка. Роль белков плазмы крови в гомеостазе ионов водорода весьма мала. |





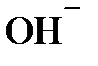 – ионы нейтрализуются кислотным компонентом буферного раствора:
– ионы нейтрализуются кислотным компонентом буферного раствора: + СН3СООН ⇄ СН3СОО – + Н2О.
+ СН3СООН ⇄ СН3СОО – + Н2О.
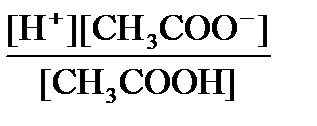 .
. ,
, . Это уравнение называют уравнением Гендерсона – Гассельбаха.
. Это уравнение называют уравнением Гендерсона – Гассельбаха. , рН =14 – рК(основания) – lg
, рН =14 – рК(основания) – lg  , где рК = –lg
, где рК = –lg  (Н2СО3) = 6,1
(Н2СО3) = 6,1 на константу растворимости СО2. Если
на константу растворимости СО2. Если  выражено в кПа, уравнение приобретает следующую форму:
выражено в кПа, уравнение приобретает следующую форму:
 плазмы крови 5,3 кПа эти две ткани поддерживают в норме постоянную внеклеточную концентрацию гидрокарбонат-ионов 24 ммоль/л. Соотношение во внеклеточной жидкости [НС
плазмы крови 5,3 кПа эти две ткани поддерживают в норме постоянную внеклеточную концентрацию гидрокарбонат-ионов 24 ммоль/л. Соотношение во внеклеточной жидкости [НС  ] / [СО2] (обе величины в ммоль/л) составляет 20:1. По уравнению Гендерсона–Гассельбаха это соотношение соответствует величине рН плазмы крови, равной 7,4:
] / [СО2] (обе величины в ммоль/л) составляет 20:1. По уравнению Гендерсона–Гассельбаха это соотношение соответствует величине рН плазмы крови, равной 7,4: = 6,1 + lg20 = 6,1 + 1,3 = 7,4
= 6,1 + lg20 = 6,1 + 1,3 = 7,4 ] / [СО2] < 20 является причиной ацидоза. Ацидоз может быть обусловлен повышенным образованием ионов водорода Н+ или усиленным выделением из организма гидрокарбонатов.
] / [СО2] < 20 является причиной ацидоза. Ацидоз может быть обусловлен повышенным образованием ионов водорода Н+ или усиленным выделением из организма гидрокарбонатов.
 :
: ⇄ Н+ +
⇄ Н+ + 
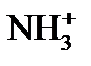 ) и основными свойствами (–СОО– и –NH2). Механизм действия такой буферной системы можно представить следующим образом:
) и основными свойствами (–СОО– и –NH2). Механизм действия такой буферной системы можно представить следующим образом: