 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Влияние концентрации на скорость реакции
Д.Г.НАРЫШКИН КОНСПЕКТ ЛЕКЦИЙ По курсу «ХИМИЯ»
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Возможности компьютерной математики при исследовании поведения химических систем во времени
МОСКОВСКИЙ ЭНЕРГЕТИЧЕСКИЙ ИНСТИТУТТУ)
ОГЛАВЛЕНИЕ ВВЕДЕНИЕ 3 1. ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ КИНЕТИКИ 1.1. Скорость реакции 1.2. Влияние концентрации на скорость реакции 1.3. Молекулярность и порядок реакции 1.4. Прямая и обратная задача химической кинетики 1.5. Реакция первого порядка 1.6. Реакции второго порядка 1.7. Реакции других порядков 1.8. Методы определения порядка реакции 2. Сложные реакции 2.1. Кинетика обратимых реакций 2.2 Параллельные реакции 2.3 Последовательные реакции 2.4 Метод квазистационарных концентраций 3. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ 3.1.Уравнение Аррениуса 3.2. Связь энергии активации с тепловым эффектом реакции 3.3. Связь между скоростью реакции и равновесием 4. КИНЕТИКА ГЕТЕРОГЕННЫХ РЕАКЦИЙ 4.1. Общие понятия 4.2. Макрокинетика. Внешнедиффузионная область 4.3. Макрокинетика. Внутридиффузионное торможение КИНЕТИКА РЕАКЦИЙ В ОТКРЫТЫХ СИСТЕМА 5.1.Химические реакторы. 5.2. Реакторы идеального смешения. 5.3. Реакторы идеального вытеснения. 5.4. Обратимые химические реакции в реакторах в реакторах смешения и вытеснения. 6. Задачи 7. Заключение 8. Рекомендуемая литература ВВЕДЕНИЕ Термодинамический метод изучения химических реакций позволяет сделать вывод о принципиальной возможности исследуемого процесса в тех или иных условиях и о глубине его протекания. При постоянстве давления и температуры самопроизвольное протекание процесса возможно только в направлении уменьшения энергии Гиббса. Условие Это обстоятельство связано с тем, что Однако химические реакции могут протекать с самыми различными скоростями – от взрывных до очень медленных, протекающих в течение многих месяцев и лет. Даже одна и та же реакция, протекающая на различных катализаторах, может иметь скорости, различающиеся во много раз. В некоторых случаях необходимо увеличить скорость реакции, в других наоборот, уменьшить. Таких примеров можно привести множество. Поэтому изучение скорости протекания химических процессов (а это и составляет задачу кинетики) чрезвычайно важно. Для рационального проведения химических реакций необходимо уметь управлять ими, знать зависимости скорости от различных параметров. По кинетике издано очень много учебной и методической литературы. Но все эти книги и учебные пособия написаны так, что хочется спросить: «Какое, милые, тысячелетье на дворе?» Современные системы компьютерной математики позволяют дать быстрый, и что, пожалуй, главное, наглядный прогноз относительно поведения химической системы во времени. Однако в русскоязычной учебной литературе по кинетике химических реакций подход, в котором используются средства символьной математики в совокупности со средствами решения систем дифференциальных уравнений, представляемые математическим пакетом Mathcad, практически отсутствует. Поэтому, отвечая на естественный вопрос – чем предлагаемое учебное пособие отличается от множества других, можно ответить: настоящее пособие имеет цель продемонстрировать эффективность применения математического пакета Mathcad для решения задач химической кинетики. Специальные химические дисциплины, такие как термодинамика и кинетика, достаточно математизированы, и часто решение химической задачи вызывает у студентов значительные трудности, связанные с математикой – довольно часто это приводит к тому, что приходится сознательно упрощать задачу. Пособие иллюстрирует богатейшие возможности, которые открывает применение компьютерной математики перед исследователем для анализа поведения химических систем во времени. В этом отношении математические пакеты становятся практически незаменимыми элементами обучения, позволяющими сделать акцент на содержательном анализе полученных результатов. Знаком >>>>>> в тексте пособия отмечен переход к Mathcad документу для интерактивного расчета.
1. ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ КИНЕТИКИ
Скорость реакции
Химическая кинетика – наука о скоростях и закономерно-стях протекания химических процессов во времени. Химическая кинетика изучает механизм протекания процесса, т.е. те промежуточные стадии, состоящие из элементарных актов, через которые система переходит из начального состояния в конечное. Химическая кинетика изучает скорости этих стадий и факторы, влияющие на их скорость. Уравнение химической реакции показывает начальное состояние системы (исходные вещества) и её конечное состояние (продукты реакции), но не отражает механизма процесса. Однако путь перехода системы из начального в конечное состояние может быть достаточно сложным и «извилистым».
протекает по следующему механизму: первая стадия
вторая стадия
третья стадия
Изучить кинетику реакции – значит показать, как реально протекает исследуемая реакция, её механизм, получить зависимость, связывающую скорость реакции с факторами, влияющими на неё. Различают два типа химических реакций: гомогенные и гетерогенные. К гомогенным относят реакции, у которых и исходные вещества и продукты реакции находятся в одной фазе. Взаимодействие веществ в таких реакциях происходит по всему объёму. К гетерогенным реакциям относят реакции, протекающие на границе раздела фаз.
Пусть протекает реакция
где a1, a2, ai, b1, b2, bj – стехиометрические коэффициенты. Скорость реакции по i–му веществу в гомогенной системе определяется как количество i-го вещества, образующееся (или реагирующее) в единице реакционного объёма в единицу времени:
где V – объём реакционной зоны, Ni – количество i–го вещества. Если реакция протекает изохорически, т.е. объём во время реакции не меняется, то, поскольку концентрация и объём связаны соотношением
скорость реакции можно определить как изменение концентрации вещества во времени
Ранее мы определили скорость химической реакции как изменение числа молей реагирующих веществ в единицу времени в единице объема, т. е.
где Таким образом определяется средняя скорость реакции для заданного интервала времени. Если объем в процессе реакции постоянен, то
где
Тогда
(скорость всегда положительна, а Если интервал времени
или
Размерность скорости: моль/(л·с).
Не только знак, но и абсолютное значение скорости зависит от того, по какому из участников реакции она измерена. Так, например, при протекании реакции
скорость, с которой уменьшается концентрация водорода во время процесса, в три раза больше скорости убывания концентрации азота и в полтора раза выше скорости возрастания концентрации аммиака. Следовательно, для реакции
скорости по компонентам реакции будут связаны соотношением:
Экспериментально установлено, что скорость реакции зависит от природы реагирующих веществ, их концентрации (или давления), температуры, т.е.
Раскрытие этой зависимости и составляет одну из задач кинетики.
Влияние концентрации на скорость реакции
Подход к выяснению зависимости скорости реакции от концентрации реагирующих веществ можно иллюстрировать следующим положением теории вероятностей: вероятность одновременного осуществления независимых событий равна произведению вероятностей каждого из них. Для того чтобы произошло химическое взаимодействие, например, реакция
A+B→продукты,
необходимо, но не достаточно, столкновение реагирующих молекул А и В, т.е. одновременное нахождение их в определённой точке реакционного пространства. Вероятность ω нахождения молекулы для каждого из веществ прямо пропорциональна количеству молекул в единице объёма, т.е. его концентрации:
Тогда вероятность того, что обе молекулы будут одновременно находиться в одной точке пространства, т.е. что они столкнутся, равна
Но не все столкновения приведут к реакции, а лишь их некоторая доля α, величина которой зависит от температуры и природы веществ, поэтому скорость реакции
A + B → продукты
равна
или
Постоянную k, не зависящую от концентрации и зависящую только от температуры и природы реагирующих веществ, называют константой скорости реакции. Численное значение k выражает скорость реакции, когда концентрации реагирующих веществ равны 1 моль/л.
Обобщим сказанное. Пусть протекает химическая реакция: aA + bB + … → продукты. Тогда зависимость скорости реакции от концентрации можно выразить соотношением
Полученное выражение называют законом действия масс.
|



 определяет принципиальную возможность проведения процесса в заданных условиях из начального состояния в конечное, но не позволяет оценить скорость такого перехода.
определяет принципиальную возможность проведения процесса в заданных условиях из начального состояния в конечное, но не позволяет оценить скорость такого перехода. реакции не зависит от пути (механизма) процесса, а определяется только начальным и конечным состоянием системы.
реакции не зависит от пути (механизма) процесса, а определяется только начальным и конечным состоянием системы.



 (1.1)
(1.1) (1.2)
(1.2) ,
,

 — изменение числа молей одного из исходных веществ за время
— изменение числа молей одного из исходных веществ за время  .
.
 — изменение концентрации.
— изменение концентрации. или
или 
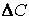 может быть больше или меньше нуля в зависимости от того, изменение концентрации исходного вещества или продукта реакции мы рассматриваем).
может быть больше или меньше нуля в зависимости от того, изменение концентрации исходного вещества или продукта реакции мы рассматриваем).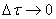 , то мы получим истинную скорость реакции r в данный момент времени, т. е.
, то мы получим истинную скорость реакции r в данный момент времени, т. е.
 (1.3)
(1.3)



 ,
,  .
.


 (1.4)
(1.4)